NMR spektroskopie při řešení struktury proteinů
NMR spektroskopie je výborná metoda pro studium struktury proteinů, jakožto i jejich dynamického chování, komplexačních schopností a celé řady dalších důležitých fyzikálně-chemických vlastností. Pro získání prostorové struktury je nutné protein nejprve izotopově obohatit atomy 13C a 15N (všechny atomy uhlíku a dusíku v molekule jsou nahrazeny těmito izotopy). Toho lze dosáhnout expresí příslušného proteinu vhodným expresním systémem (např. v bakteriích Escherichia coli) v izotopově obohaceném růstovém médiu.
Interpretací multidimensionálních multinukleárních NMR experimentů lze přiřadit 1H, 13C a 15N rezonance příslušného proteinu. V další fázi se získávají experimentální NMR parametry (NOE, interakční konstanty, reziduální dipolární interakční konstanty...), které lze přímo využít pro výpočet prostorové struktury proteinu. Dynamické vlastnosti proteinů se získávají měřením relaxačních vlastností jader 13C a 15N. Podrobnější informace o studiu proteinů pomocí NMR je možné získat v rámci námy vyučovaných předmětů.
V naší laboratoři využíváme NMR spektroskopii pro studium prostorové struktury a různých fyzikálně-chemických vlastností* retrovirových proteinů. Retroviry jsou podskupinou virů, jejichž genetická informace je kódována diploidní ribonukleovou kyselinou RNA a pomocí enzymu zvaného reverzní transkriptasa je přepisována do příslušné DNA, která je poté vložena do genomu hostitelské buňky.
Nejznámějším a nejlépe prozkoumaným retrovirem je virus HIV-1, který je příčinou nemoci AIDS (Acquired ImmunoDeficiency Syndrome). V naší laboratoři jsme se zaměřili na Masonův-Pfizerův opičí virus (zkratka M-PMV). Tento virus byl poprvé izolován z prsního tumoru opice druhu Makak. M-PMV není člověku přímo nebezpečný, ale představuje vynikající modelový systém pro studium obecných zákonitostí různých fází života retrovirů.
Studované projekty
- Studium struktury matrixového proteinu Mason-Pfizerova opičího viru a jeho interakce s cytoplasmatickou membránou
- Studium vztahů mezi strukturou a funkcí fenotypově významných mutantů matrixového proteinu Masonova-Pfizerova opičího viru.
Studium struktury matrixového proteinu Mason-Pfizerova opičího viru a jeho interakce s cytoplasmatickou membránou
Na obrázku 1 je schematicky znázorněna zralá retrovirová částice. Matrixový protein (MA), který tvoří vnější proteinový obal a těsně přilehá na vnitřní stranu lipidové membrány, je exprimován jako N-terminální doména polyproteinového prekursoru Gag a je odpovědný za celou řadu životních funkcí retrovirů. Především řídí transport proteinových prekursorů do místa skládání (vytvoření) nezralé virové částice, dále je odpovědný za její transport k plasmatické membráně, s níž se také přímo váže a zprostředkovává tak vazbu virové částice k membráně. MA interaguje s membránou pomocí oblasti bazických aminokyselin a také zbytkem kyseliny myristové, který je kovalentně připojen k jeho N-konci.
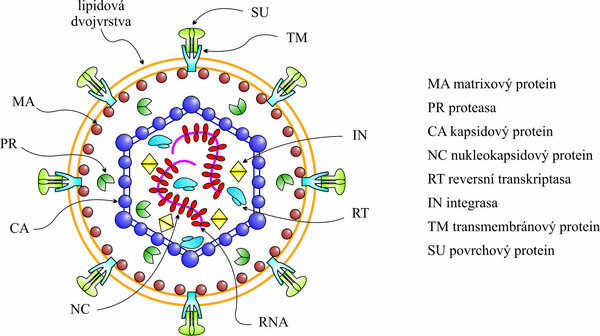
Obr. 1. Vnitřní uspořádání zralé retrovirové částice. Pod lipidovou dvojvrstvou obsahující transmembránovou (TM – světle modře) a povrchovou (SU – světle zeleně) jednotku Env proteinu je ukotven matrixový protein (MA – tmavě červeně). Vlastní core retroviru je složeno z kapsidového (CA – fialově) a nukleokapsidového (NC – červeně) proteinu, který chrání diploidní retrovirovou RNA (růžově). V core se dále nachází enzymy integrasa (IN – žlutě), reversní transkriptasa (RT – modře) a také proteasa (tmavě zeleně). V případě Masonova-Pfizerova opičího viru je MA, podobně jako u mnoha dalších retrovirů, na N konci kotranslačně myristoylován.
Struktura myristoylovaného matrixového proteinu M-PMV
V naší laboratoři jsme určili strukturu M-PMV MA a to jak jeho nemyristoylované formy, tak i jeho myristoylované formy. Struktury obou forem jsou si podobné, jsou složeny ze 4 helixů v podobném uspořádání jako u MA jiných retrovirů. Kyselina myristová je zanořena do jádra proteinu. Při srovnání struktury myristoylované a nemyristoylované formy MA je patrné, že myristoylace způsobila mírnou změnu orientace I. a II. helixu (Obr. 2), která je důležitá pro interakci se složkami cytoplasmatické membrány.
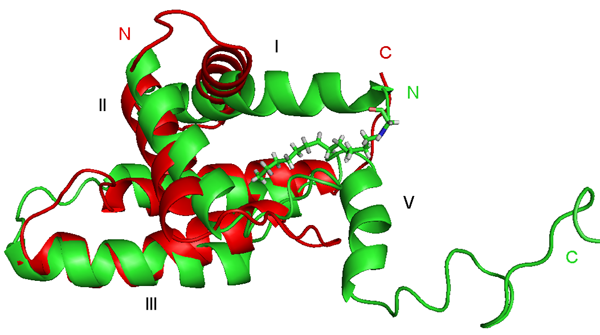
Obr. 2. Srovnání struktury myristoylované (zelená) a nemyristoylované (červená) formy M-PMV MA.
Oligomerizace matrixového proteinu.
Rentgenová struktura matrixového proteinu HIV-1 ukázala, že MA tvoří trimery. HIV-1 MA trimerizuje i v roztoku, ovšem pouze v myristoylované formě. Myr(−) HIV-1 MA nevykazuje v roztoku žádné známky oligomerizace.
Nám se podařilo kombinovaným využitím mapování změn chemických posunů se změnou koncentrace měřeného vzorku (Obr. 3) a změřením translačních difusních koeficientů pomocí gradientní NMR spektroskopie prokázat, že myr(−) M-PMV MA ochotně tvoří dimery a trimery. Tyto výsledky jsou potvrzeny také oligomerizací myr(−) MA, která probíhá jak samovolně v neredukujícím prostředí, tak i za pomoci chemického prokřížení.
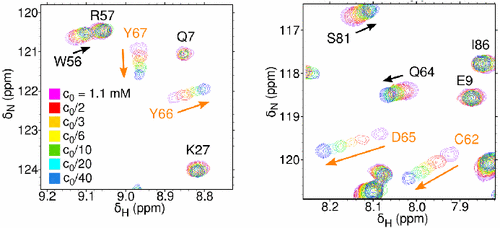
Obr. 3. Překryvy dvou vybraných oblastí 1H-15N HSQC spektra měřených za různých koncentrací WT MA. Oranžovými šipkami jsou označena residua s významnou změnou chemického posunu.
Na základě intenzity změn v chemických posunech v závislosti na koncentraci vzorku jsme nalezli aminokyseliny, které jsou odpovědné za oligomerizaci MA. Nacházejí se ve spojce mezi druhým a třetím helixem a ve třetím helixu a tvoří spojitou oblast na povrchu proteinu – interakční rozhraní (Obr. 4a).
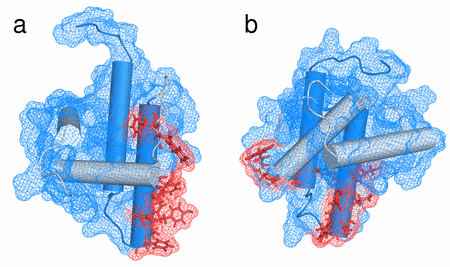
Obr. 4. Interakční rozhraní nalezené na WT MA a zobrazené na WT MA (a) a R55F MA (b). Residua interakčního rozhraní jsou vyznačena červeně.
Molekulárním modelováním se zahrnutím změn v chemických posunech byla navržena možná struktura dimeru a trimeru WT MA, které jsou znázorněny na Obrázku 5.
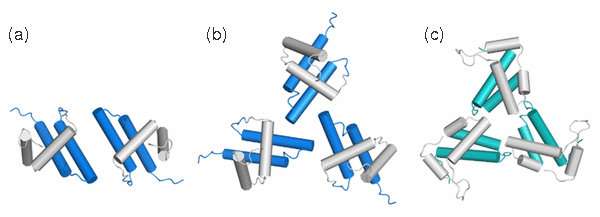
Obr. 5. Modely struktur dimeru (a) a trimeru (b) WT MA vypočítané v programu HADDOCK. Pro srovnání je zde uvedena i struktura trimeru HIV-1 (c, PDB ID 1HIW).
Při studiu myristoylované formy M-PMV MA bylo ovšem překvapivě zjištěno, že myrMA oligomery netvoří. Na rozdíl od (myr-)MA nedochází při změně koncentrace k významným změnám chemických posunů signálů jeho aminokyselin (Obr. 6) a ani jinými metodami se oligomerizaci nepodařilo prokázat. Rozdílné chování obou forem lze vysvětlit změnou konformace oligomerizačního rozhraní způsobenou myristoylací, kdy některé aminokyseliny účastnící se oligomerizace jsou ve struktuře myrMA ukryty. Oligomerizace M-PMV MA tedy nemůže ovlivňovat skládání částice v buňce, protože myristoylovaný MA neoligomerizuje. Je ovšem možné, že po navázání MA na cytoplasmatickou membránu dojde ke konformační změně, která oligomerizaci umožní a ta se bude moci uplatnit například při interakci s proteinem Env.
Interakce s cytoplasmatickou membránou
MA se nachází na povrchu nezralé virové částice a je proto zodpovědný za interakci s buněčnou membránou když virus opouští hostitelskou buňku. Jednou z podstatných složek buněčné membrány je fosfatidylinositol[4,5]-bisfosfát (PI[4,5]P2). V případě matrixového proteinu HIV-1 bylo prokázáno, že se specificky váže na MA a tato interakce je pravděpodobným spouštěcím mechanismem myristoylového přepínače, kdy dojde k expozici zbytku kyseliny myristové, která je takto připravena pro interakci s membránou. Při studiu interakce M-PMV MA s PI[4,5]P2 jsme zjistili, že M-PMV MA také interaguje s PI[4,5]P2, ovšem v mnoha ohledech se od HIV-1 MA odlišuje.
PI[4,5]P2 se váže do vazebného místa mezi I., II. a IV. helixem (Obr. 6). S PI[4,5]P2 interaguje pouze myrMA, protože u (myr-)MA je vazebné místo uzavřeno rozdílnou orientací I. a II. helixu. PI[4,5]P2 má v kavitě zanořené zbytky mastných kyselin zatímco inositolová skupina zůstává na povrchu. Stejně jako je tomu u HIV-1 jedna z mastných kyselin je zanořena přímo do středu proteinu, kdežto druhá je zanořená částečně a její konec směřuje k povrchu proteinu. Tato orientace naznačuje, že v případě přirozeného PI[4,5]P2 jedna z mastných kyselin zůstala jako kotva v cytoplasmatické membráně, stejně jako bylo navrženo u HIV-1 MA. Fosfátové skupiny jsou blízko povrchu a interagují s bazickými aminokyselinami MA (Obr. 7). Celkově je struktura komplexu M-PMV MA s PI[4,5]P2 podobná struktuře komplexu HIV-1 i HIV-2 MA s PI[4,5]P2.
Zkoumali jsme i závislost interakce na různé fosforylaci PIP. Testovali jsme interakci MA s PIP fosforylovanými v pozicích 3; 3,4; 4; 4,5 a 3,4,5. Ve všech případech byla interakce srovnatelná s PI[4,5]P2 a nepodařilo se najít rozdíly v preferenci jednotlivých forem PIP, na rozdíl od HIV-1 a HIV-2 MA, kde byl PI[4,5]P2 jednoznačně preferovaný.
Celkově je interakce PI[4,5]P2 s M-PMV MA slabší než s HIV-1 MA. U M-PMV MA, na rozdíl od HIV-1 MA, také při interakci s rozpustným PI[4,5]P2 s krátkými zbytky mastných kyselin nedochází k uvolnění myristoylu z jádra proteinu.
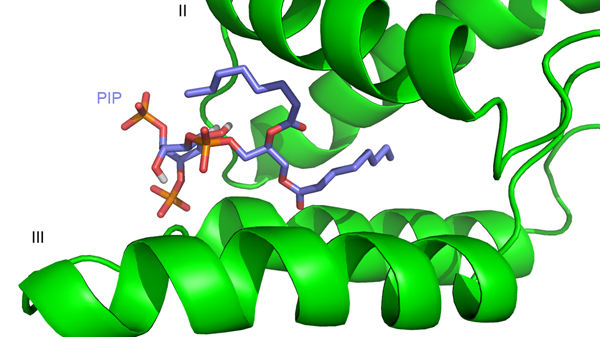
Obr. 6 Komplex myristoylovaného MA (zelený) s PI[4,5]P2 vypočtený v programu HADDOCK.
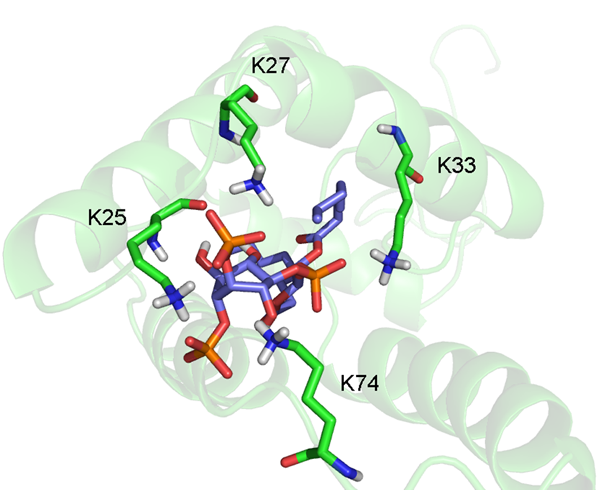
Obr. 7 Komplex myristoylovaného MA (zelený) s PI[4,5]P2se zvýrazněnou interakcí lyzinových zbytků MA (zelené) s fosfátovými skupinami PI[4,5]P2 (červené).
Vybrané publikace:
- Vlach J., Srb P., Prchal J., Grocký M., Lang J., Ruml T., Hrabal R. (2009) Nonmyristoylated Matrix Protein from the Mason-Pfizer Monkey Virus Forms Oligomers. J. Mol. Biol., 390(5), 967–980. doi:10.1016/j.jmb.2009.05.063
- Srb P., Vlach J., Prchal J., Grocký M., Ruml T., Lang J., Hrabal R. (2011) Oligomerization of a retroviral matrix protein is facilitated by backbone flexibility on nanosecond time scale. J. Phys. Chem. B, 115(11), 2634-2644.doi: 10.1021/jp110420m
- Prchal J., Junková P., Strmisková M., Lipov J., Hynek R., Ruml T., Hrabal R. (2011) Expression and purification of myristoylated matrix protein of Mason-Pfizer monkey virus for NMR and MS measurements. Protein Expr. Purif., 79(1), 122-127. doi: 10.1016/j.pep.2011.05.010
- Prchal, J., Srb, P., Hunter, E., Ruml, T., Hrabal, R. (2012)The Structure of Myristoylated Mason-Pfizer Monkey Virus Matrix Protein and the Role of Phosphatidylinositol-(4,5)-bisphosphate in its Membrane Binding.J.Mol.Biol., in press, doi:10.1016/j.jmb.2012.07.021
Studium vztahů mezi strukturou a funkcí fenotypově významných mutantů matrixového proteinu Masonova-Pfizerova opičího viru.
Změna místa skládání nezralé virové částice.
Z hlediska místa skládání nezralé virové částice se retroviry dělí na C- a D-typ (Obr. 8). Retroviry C-typu (HIV-1) skládají nezralé virové částice na vnitřní straně buněčné membrány, zatímco viry typu D (M-PMV) v tzv. pericentriolární oblasti infikované buňky. Rozdíl mezi oběma fenotypy je velmi nepatrný, jak bylo prokázáno mutacemi matrixového proteinu M-PMV a později i u HIV-1. V případě M-PMV byl zaměněn arginin v pozici 55 za hydrofobní aromatickou aminokyselinu (Trp, Phe), čímž dochází ke změně místa skládání kapsidy z pericentriolární oblasti na vnitřní stranu plasmatické membrány (konverze D-typu na C-typ). Různými experimenty bylo prokázáno, že fenotyp typu D je závislý na buněčném transportním systému dyneinu.
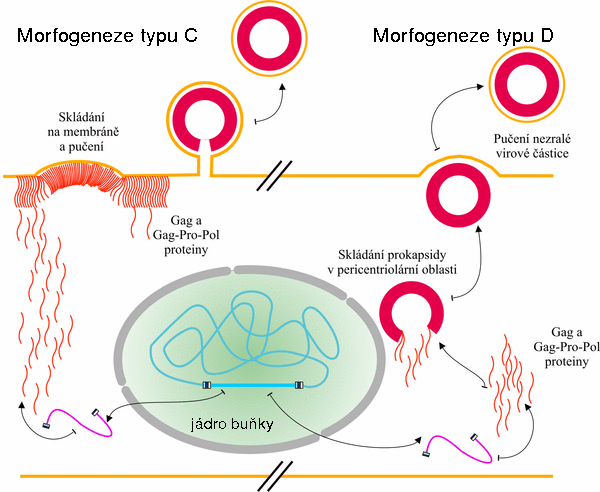
Obr. 8. Dvě různé morfogeneze retrovirů, typ C a typ D. U retrovirů typu C (např. u HIV-1) dochází ke skládání virové částice na cytoplasmatické membráně hostitele (vlevo), kdežto u retrovirů typu D (M-PMV) se Gag prekursory skládají v prokapsidu v pericentriolární oblasti buňky, odkud je tato prokapsida transportována k membráně, kde vypučí (na obrázku vpravo).
V naší laboratoři se podařilo určit strukturu jak divokého typu matrixového proteinu (wt MA), tak mutantu R55F (Obr. 9). Zásadním rozdílem mezi oběma proteiny je přístupnost tzv. CTRS domény (Cytoplasmic Targeting and Retention Signal), která je odpovědná za cílení virových proteinů do pericentriolární oblasti prostřednictvím interakce s lehkým řetězcem dyneinu (Tctex-1). CTRS v nemutovaném MA je plně exponovaná na povrchu proteinu, a tedy přístupná k interakci s buněčným transportním systémem. Ve struktuře mutantu R55F dochází k omezení její přístupnosti v důsledku vzájemné reorientace N- (helix I a II) a C-koncové domény (helix III a IV) proteinu. Prokázali jsme tedy, že v důsledku omezené přístupnosti CTRS domény nemůže Gag polyprotein interagovat s dyneinem, čímž je zablokován mechanismus transportu Gag polyproteinů do oblasti poblíž jádra buňky. Místo toho je v mutantu R55F aktivován tzv. bipartitní transportní signál, kterým jsou Gag proteiny dopravovány k vnitřní straně plasmatické membrány. Tím dochází ke změně fenotypu viru z D na C.
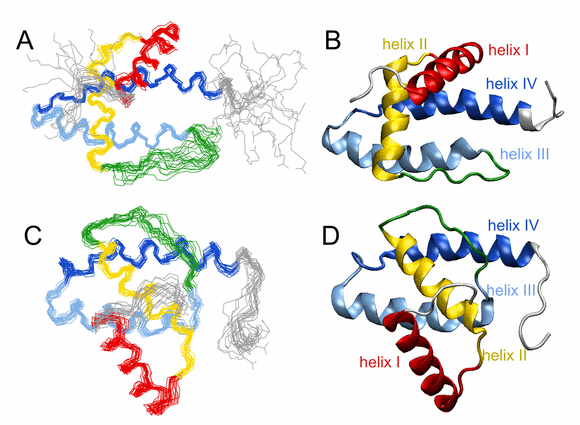
Obr. 9. Srovnání struktur wt MA a R55F, (A) Superpozice 18 nejlepších struktur wt MA, (B) průměrná struktura wt MA, (C) superpozice 15 nejlepších struktur R55F, (D) průměrná struktura R55F. Jednotlivé α-helixy jsou popsány a všechny důležité strukturní prvky jsou barevně odlišeny.
Na rozdíl od WT MA mutant R55F nevykazoval téměř žádné známky oligomerizace. Rozdílné chování obou proteinů lze vysvětlit na základě jejich odlišné struktury, resp. odlišné přístupnosti CTRS domény, která je majoritní složkou oligomerizační domény (Obr. 4b).
Vybrané publikace:
- Vlach, J., Lipov, J., Veverka, V., Rumlová, M., Ruml, T., Hrabal, R. 2005. Assignment of H-1, C-13, and N-15 resonance of wt matrix protein and its R55F mutant from Mason-Pfizer monkey virus. J. Biomol. NMR. 31: 381-382. doi: 10.1007/s10858-005-2473-x
- Vlach J., Lipov J., Rumlová M., Veverka V., Lang J., Srb P., Knejzlík Z., Pichová I., Hunter E., Hrabal R., Ruml T. 2008. D-retrovirus morhogenetic switch driven by the targeting signal accessibility to Tctex-1 of dynein. Proc. Natl. Acad. USA 105: 10565-10570. doi: 10.1073/pnas.0801765105
