stdClass Object
(
[nazev] => Centrální laboratoře VŠCHT Praha
[adresa_url] =>
[api_hash] =>
[seo_desc] =>
[jazyk] =>
[jednojazycny] =>
[barva] =>
[indexace] => 1
[obrazek] =>
[ga_force] =>
[cookie_force] =>
[secureredirect] =>
[google_verification] => UOa3DCAUaJJ2C3MuUhI9eR1T9ZNzenZfHPQN4wupOE8
[ga_account] => UA-10822215-3
[ga_domain] =>
[ga4_account] => G-VKDBFLKL51
[gtm_id] =>
[gt_code] =>
[kontrola_pred] =>
[omezeni] =>
[pozadi1] =>
[pozadi2] =>
[pozadi3] =>
[pozadi4] =>
[pozadi5] =>
[robots] =>
[htmlheaders] =>
[newurl_domain] => 'clab.vscht.cz'
[newurl_jazyk] => 'cs'
[newurl_akce] => '[cs]'
[newurl_iduzel] =>
[newurl_path] => 1/20076/20077
[newurl_path_link] => Odkaz na newurlCMS
[iduzel] => 20077
[platne_od] => 26.05.2023 09:28:00
[zmeneno_cas] => 26.05.2023 09:28:37.644961
[zmeneno_uzivatel_jmeno] => Jan Kříž
[canonical_url] =>
[idvazba] => 24781
[cms_time] => 1752395221
[skupina_www] => Array
(
)
[slovnik] => stdClass Object
(
[logo_href] => /
[logo] =>  [logo_mobile_href] => /
[logo_mobile] =>
[logo_mobile_href] => /
[logo_mobile] =>  [google_search] => 001523547858480163194:u-cbn29rzve
[social_fb_odkaz] =>
[social_tw_odkaz] =>
[social_yt_odkaz] =>
[intranet_odkaz] => http://intranet.vscht.cz/
[intranet_text] => Intranet
[mobile_over_nadpis_menu] => Menu
[mobile_over_nadpis_search] => Hledání
[mobile_over_nadpis_jazyky] => Jazyky
[mobile_over_nadpis_login] => Přihlášení
[menu_home] => Domovská stránka
[paticka_budova_a_nadpis] => BUDOVA A
[paticka_budova_a_popis] => Rektorát, oddělení komunikace, pedagogické oddělení, děkanát FCHT, centrum informačních služeb
[paticka_budova_b_nadpis] => BUDOVA B
[paticka_budova_b_popis] => Věda a výzkum, děkanát FTOP, děkanát FPBT, děkanát FCHI, výpočetní centrum, zahraniční oddělení, kvestor
[paticka_budova_c_nadpis] => BUDOVA C
[paticka_budova_c_popis] => Dětský koutek Zkumavka, praktický lékař, katedra ekonomiky a managementu, ústav matematiky
[paticka_budova_1_nadpis] => NÁRODNÍ TECHNICKÁ KNIHOVNA
[paticka_budova_1_popis] =>
[paticka_budova_2_nadpis] => STUDENTSKÁ KAVÁRNA CARBON
[paticka_budova_2_popis] =>
[paticka_adresa] => VŠCHT Praha
[google_search] => 001523547858480163194:u-cbn29rzve
[social_fb_odkaz] =>
[social_tw_odkaz] =>
[social_yt_odkaz] =>
[intranet_odkaz] => http://intranet.vscht.cz/
[intranet_text] => Intranet
[mobile_over_nadpis_menu] => Menu
[mobile_over_nadpis_search] => Hledání
[mobile_over_nadpis_jazyky] => Jazyky
[mobile_over_nadpis_login] => Přihlášení
[menu_home] => Domovská stránka
[paticka_budova_a_nadpis] => BUDOVA A
[paticka_budova_a_popis] => Rektorát, oddělení komunikace, pedagogické oddělení, děkanát FCHT, centrum informačních služeb
[paticka_budova_b_nadpis] => BUDOVA B
[paticka_budova_b_popis] => Věda a výzkum, děkanát FTOP, děkanát FPBT, děkanát FCHI, výpočetní centrum, zahraniční oddělení, kvestor
[paticka_budova_c_nadpis] => BUDOVA C
[paticka_budova_c_popis] => Dětský koutek Zkumavka, praktický lékař, katedra ekonomiky a managementu, ústav matematiky
[paticka_budova_1_nadpis] => NÁRODNÍ TECHNICKÁ KNIHOVNA
[paticka_budova_1_popis] =>
[paticka_budova_2_nadpis] => STUDENTSKÁ KAVÁRNA CARBON
[paticka_budova_2_popis] =>
[paticka_adresa] => VŠCHT Praha
Technická 5
166 28 Praha 6 – Dejvice
IČO: 60461373
DIČ: CZ60461373
Datová schránka: sp4j9ch
Copyright VŠCHT Praha 2014
Za informace odpovídá Oddělení komunikace, technický správce Výpočetní centrum
[paticka_odkaz_mail] => mailto:Josef.Chudoba@vscht.cz
[zobraz_desktop_verzi] => zobrazit plnou verzi
[social_fb_title] =>
[social_tw_title] =>
[social_yt_title] =>
[drobecky] => Nacházíte se: VŠCHT Praha – Centrální laboratoře
[aktualizovano] => Aktualizováno
[autor] => Autor
[stahnout] => Stáhnout
[more_info] => více informací
[paticka_mapa_odkaz] =>
[zobraz_mobilni_verzi] => zobrazit mobilní verzi
[nepodporovany_prohlizec] => Ve Vašem prohlížeči se nemusí vše zobrazit správně. Pro lepší zážitek použijte jiný.
[preloader] => Prosím počkejte chvíli...
[social_in_odkaz] =>
[hledani_nadpis] => hledání
[hledani_nenalezeno] => Nenalezeno...
[hledani_vyhledat_google] => vyhledat pomocí Google
[social_li_odkaz] =>
)
[poduzel] => stdClass Object
(
[20079] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[20083] => stdClass Object
(
[obsah] =>
[iduzel] => 20083
[canonical_url] => //clab.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[20084] => stdClass Object
(
[obsah] =>
[iduzel] => 20084
[canonical_url] => //clab.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[20085] => stdClass Object
(
[obsah] =>
[iduzel] => 20085
[canonical_url] => //clab.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
)
[iduzel] => 20079
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[20080] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[25142] => stdClass Object
(
[nazev] => Laboratoř atomové absorpční spektrometrie
[seo_title] => Laboratoř atomové absorpční spektrometrie
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] => Analýzy
V laboratoři se provádí stanovení prakticky všech kovových prvků ve vzorcích anorganického popřípadě i organického charakteru metodami atomové spektrometrie, tj. atomovou absorpční spektrometrií (s plamenovou i elektrotermickou atomizací).
Laboratoř provádí stanovení prvků přítomných v koncentracích 100 – 10–7% a nižších metodou atomové absorpční spektrometrie (AAS) s plamenovou i bezplamennou atomizací. Vzorky jsou měřeny převážně jako roztoky ve vodném i organickém prostředí (metanol, etanol), v omezeném množství je možné provádět i základní rozklady. Stanovení rtuti je možno provést přímo i v pevném vzorku.
V laboratoři se provádí měření těchto prvků (mez detekce v mg/l pro plamenovou techniku atomizace):
|
Ag (0.03)
|
Al (0.4)
|
As (0.6)
|
Au (0.1)
|
|
|
|
B (8)
|
Ba (0.2)
|
Be (0.02)
|
Bi (0.2)
|
|
|
|
Ca (0.01)
|
Cd (0.005)
|
Co (0.05)
|
Cr (0.06)
|
Cs (0.04)
|
Cu (0.04)
|
|
Fe (0.05)
|
Ga (0.7)
|
Ge (1.5)
|
Hg (5)
|
In (0.2)
|
|
|
K (0.01)
|
La (1)
|
Li (0.02)
|
Mg (0.003)
|
Mn (0.02)
|
Mo (0.3)
|
|
Na (0.003)
|
Ni (0.05)
|
Pb (0.1)
|
Pd (0.1)
|
Pt (1.5)
|
|
|
Rb (0.03)
|
Rh (0.15)
|
Sb (0.3)
|
Se (0.5)
|
Si (1.0)
|
|
|
Sn (1)
|
Sr (0.05)
|
Ta (11)
|
Ti (1.5)
|
|
|
|
Tl (0.3)
|
V (0.75)
|
W (6)
|
Zn (0.05)
|
|
|
U některých prvků je možné dosáhnout nižších mezí detekce s použitím AAS s elektrotermickou atomizací (Hg) a AAS s hydridovou technikou (As, Se, Sb). Tato stanovení musí být předběžně konzultována.
Další aktivity
- konzultační činnost
- aplikace pro potřeby výzkumu a monitorování v oblastech moderních technologií, zdravotnictví, životního prostředí
Využití v monitoringu životního prostředí:
- Analýza srážkových, pitných a povrchových vod, odpadních vod a výluhů ze skládek
- Kvalita ovzduší, analýzy prašných aerosolů a městského prachu
- Příprava testovacích materiálů, testování odběrových systémů, metodický výzkum prvkového zastoupení v jemných frakcích aerosolů (As, Cd, Cr, Mn, Ni, Pb).
[iduzel] => 25142
[canonical_url] => //clab.vscht.cz/aas
[skupina_www] => Array
(
)
[url] => /aas
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27634] => stdClass Object
(
[nazev] => Laboratoř NMR spektroskopie
[seo_title] => NMR
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Laboratoř NMR spektroskopie je součástí Centrálních laboratoří na Vysoké škole chemicko-technologické v Praze. Jejím hlavním posláním je servisní měření NMR spekter vzorků dodaných ze školních laboratoří, ale i z pracovišť mimo školu. Kromě základních servisních služeb je zde možné provést také nestandardní nebo složitější experimenty, včetně jejich vyhodnocení. Současně s tím v této laboratoři probíhá vědecká a pedagogická činnost, která zahrnuje úzkou spolupráci s dalšími pracovišti na VŠCHT.
Nejširší využití NMR spektroskopie nalézá v charakterizaci látek, převážně organického původu. Laboratoř NMR se kromě určení chemické struktury produktů a meziproduktů reakcí zabývá také stanovením zastoupení složek ve směsích, měřením kinetiky a termodynamiky chemických dějů, kvalitativním posouzením i kvantitativním výpočtem geometrie molekul a dynamikou molekul.
S rozvojem pokročilých technik se NMR spektroskopie stala významnou metodou pro výpočet struktury biomakromolekul – proteinů a nukleových kyselin. V současnosti řešíme prostorové struktury vybraných proteinů Masonova-Pfizerova opičího retroviru.
Ve srovnání s jinými analytickými metodami je NMR spektroskopie méně citlivou metodou, nejedná se o stopovou analýzu. (Doporučená množství vzorku pro analýzu jsou uvedena v sekci Servis.) Měření je však nedestruktivní a vzorek je možné po analýze dále použít
[iduzel] => 27634
[canonical_url] => //clab.vscht.cz/nmr
[skupina_www] => Array
(
)
[url] => /nmr
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27362] => stdClass Object
(
[nazev] => Laboratoř analýzy povrchů
[seo_title] => Laboratoř analýzy povrchů
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
K měření analýz povrchu máme k dispozici přístroj ESCAProbeP vyrobený firmou Omicron Nanotechnology Ltd. V roce 2004 Přístroj je vybaven monochromátorem, dvěma typy iontových děl, detekcí elektronů s 5 channeltrony, možností kompenzace nabíjení vzorku pomocí zdroje nízkoenergetických elektronů, zdrojem UV záření pro analýzu valenčních stavů, fokusovatelným zdrojem elektronů a detektorem sekundárních elektronů.
Nejčastěji řešené problematiky:
- Oxidační stavy katalyzátorů
- Stavy povrchů na organických materiálech
- Korozní vrstvy
- Vrstvy vyvíjené pro chemické senzory
- Materiály pro elektroniku s využitím možností měření koncentračních profilů
[iduzel] => 27362
[canonical_url] => //clab.vscht.cz/lap
[skupina_www] => Array
(
)
[url] => /lap
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27315] => stdClass Object
(
[nazev] => Laboratoř molekulové spektroskopie
[seo_title] => Laboratoř molekulové spektroskopie
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Vítáme Vás na stránkách Laboratoře molekulové spektroskopie Vysoké školy chemicko-technologické v Praze. Laboratoř molekulové spektroskopie je součástí Centrálních laboratoří VŠCHT, které jsou společným servisním a vědeckým pracovištěm všech fakult VŠCHT.
Laboratoř molekulové spektroskopie provádí identifikaci neznámých látek, určování funkčních skupin, ověřování čistoty látek a stanovení jejich obsahu ve směsích. Laboratoř využívá infračervenou a Ramanovu spektrometrii v mnoha oborech, a to ve strukturní analýze organických a anorganických materiálů, analýze cizorodých látek v životním prostředí, analýze spalných plynů, polymerů, sorbentů, plnidel a lepidel papíru a pryskyřic, lepidel pro dentální protézy, analýze barviv, plnidel a emailů využívaných při restaurování uměleckých památek a historických děl. Infračervené spektrometrie je využíváno též v analýze potravin (např. stanovení cukrů v nápojích, ethanolu v alkoholických nápojích, analýza vín a medů), v medicíně (močové konkrementy), v ekologii (např. stanovení ropných látek ve vzduchu a v zeminách, respirativního křemene v ovzduší, detekce alergenních pylů) a v průmyslové analýze (např. stanovení aditiv v olejích).
Vědecká činnost labotatoře je zaměřena na vypracovávání metodik měření, kombinaci výsledků získaných různými technikami měření, které vedou ke spolehlivějšímu řešení analytického problému.
[urlnadstranka] =>
[iduzel] => 27315
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /ir
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27275] => stdClass Object
(
[nazev] => Laboratoř transmisní elektronové mikroskopie
[seo_title] => Laboratoř transmisní elektronové mikroskopie
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Laboratoř je vybavena přístrojem EFTEM Jeol 2200 FS. Jedná se o transmisní elektronový mikroskop vybavený energiovým filtrem umožňuje pracovat při urychlovacích napětích do 200 kV. Přístroj je vybaven univerzálně a je proto vhodný k pozorování jak materiálových tak biologických vzorků.
[iduzel] => 27275
[canonical_url] => //clab.vscht.cz/tem
[skupina_www] => Array
(
)
[url] => /tem
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[25225] => stdClass Object
(
[nazev] => Laboratoř termické analýzy
[seo_title] => Laboratoř termické analýzy
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
O termické analýze
Metody termické analýzy provozované v laboratoři termické analýzy umožňují testovat/ověřit:
- procesy probíhající v tepelně namáhaných materiálech, které jsou spojeny se změnou hmotnosti (sušení, dehydratace, oxidace, …)
- tepelné zabarvení procesů v tepelně namáhaných materiálech (tání, krystalizace, skelný přechod,…)
- vliv experimentálních podmínek (rychlost ohřevu, atmosféra) na průběh dějů v tepelně namáhaných materiálech
- tepelnou stálost materiálů (rozklad)
- případně hledat vhodný postup pro tepelné zpracování široké škály materiálů
Principy metod
Termogravimetrická analýza TG
Vzorek analyzované látky se kontrolovaně zahřívá/chladí (neizotermně nebo izotermně) za současného vážení a zaznamenává se průběh hmotnosti v závislosti na teplotě a čase.
Diferenční termická analýza DTA
Vzorek analyzované látky se zahřívá/chladí kontrolovanou rychlostí současně s referencí, která se během ohřevu nemění. Zaznamenává se teplotní rozdíl vzniklý mezi vzorkem a referencí, které vznikají v důsledku dějů probíhajících v analyzovaném vzorku. Teplotní rozdíl zaznamenaný v závislosti na teplotě nebo čase vypovídá o tepelném zabarvení dějů proběhlých v analyzovaném vzorku při jeho ohřevu/chlazení (děje exotermní/endotermní).
Diferenční skenovací kalorimetrie DSC
DSC zařízení zaznamenává tepelné efekty v závislosti na teplotě, které vznikají při fázovém přechodu nebo při chemické reakci. Měřená data jsou prostřednictvím vhodné kalibrace softwarově převáděna z jednotky mikrovolt na miliwatt. Výsledky vyjadřují spotřebu nebo výdej energie během reakcí probíhající v analyzovaném vzorku.
Hmotnostní spektrometrie MS ve spojení s metodami termické analýzy
Hmotnostní spektrometr kvadrupólového typu umožňuje detekovat vybrané hmoty do 300 amu, které jsou obsaženy v plynných zplodinách, které vznikají během termické analýzy vzorků.
Infračervená spektroskopie FTIR ve spojení s termogravimetrickou metodou
V laboratoři provozovaný infračervený spektrometr umožňuje měřit spektra plynných zplodin, které vzniknou při termogravimetrické analýze vzorků.
[iduzel] => 25225
[canonical_url] => //clab.vscht.cz/ta
[skupina_www] => Array
(
)
[url] => /ta
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[21297] => stdClass Object
(
[nazev] => Centrální laboratoře
[seo_title] => Centrální laboratoře
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Centrální laboratoře byly vytvořeny jako pracoviště zabezpečující podporu vědecko-výzkumné a pedagogické činnosti fakult Vysoké školy chemicko-technologické v Praze. Jejich činnost sahá od servisních analytických měření až po spolupráci při řešení vědecko-výzkumných projektů, nezanedbatelný je i přínos pracovníků jednotlivých laboratoří pří výchově studentů. V současnosti sdružují Centrální laboratoře devět pracovišť vybavených pro analýzy nejrůznějších typů látek a materiálů. Na webových stránkách naleznete stručné informace o jednotlivých laboratořích, jejich personálním obsazení, přístrojovém vybavení a možnostech spolupráce. Rádi uvítáme jakékoliv podněty, které by mohly vést ke zkvalitnění spolupráce a poskytovaných analýz.
prof. Ing. Richard Hrabal, CSc., vedoucí Centrálních laboratoří
|
Laboratoř NMR spektroskopie
|
|
přízemí budova A, dveře 42, tel. 220 443 805
vedoucí: Ing. Jan Sýkora, Ph.D. (Jan1.Sykora@vscht.cz)
|
| Laboratoř molekulové spektroskopie (IR a Ramanova spektroskopie) |
|
3. n.p. budova A, dveře 310b, tel. 220 444 137
vedoucí: Ing. Ladislav Lapčák (Ladislav.Lapcak@vscht.cz)
|
| Laboratoř rentgenové difraktometrie a spektrometrie |
|
3. n.p. budova A, dveře P03, tel. 220 444 201
suterén budova A, dveře S38, tel. 220 445 023, 5024
vedoucí: RNDr. Jaroslav Maixner, CSc. (jaroslav.maixner@vscht.cz, tel. 730 809 852)
|
| Laboratoř hmotnostní spektrometrie |
|
suterén budova A, dveře S08, tel. 220 443 812
vedoucí: Ing. Josef Chudoba, Ph.D. (josef.chudoba@vscht.cz)
|
| Laboratoř atomové absorpční spektrometrie |
|
4. n.p. budova A, dveře 406, tel. 220 443 813
vedoucí: Ing. Dana Pokorná (dana.pokorna@vscht.cz)
|
| Laboratoř organické elementární analýzy |
|
2. n.p. budova A, dveře 275, tel. 220 443 810
vedoucí: Ing. Petr Baroš (petr.baros@vscht.cz)
|
|
Laboratoř termické analýzy
|
|
suterén budova B, dveře S28a, tel. 220 443 839
vedoucí: Ing. Jakub Havlín (jakub.havlin@vscht.cz)
|
|
Laboratoř analýzy povrchů
|
|
suterén budova B, dveře S12, tel. 220 443 073
vedoucí: doc. Ing. Petr Sajdl, CSc. (petr.sajdl@vscht.cz)
|
|
Laboratoř transmisní elektronové mikroskopie
|
|
přízemí budova A, dveře 49, tel. 220 442 042
vedoucí: Ing. Michalcová Alena, Ph.D. (alena.michalcova@vscht.cz)
|
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 21297
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /home
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[21841] => stdClass Object
(
[nazev] => Laboratoř hmotnostní spektrometrie
[seo_title] => hmotnostní spektrometrie
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Laboratoř provádí měření hmotnostních spekter organických sloučenin a směsí organických látek s využitím separační techniky plynové (GC) a reverzní kapalinové (RP-HPLC) chromatografie.
Dostupné ionizační techniky
GC/MS, přímý vstup do zdroje spektrometru (sonda, batch inlet):
* elektronová ionizace (EI+ 70 eV) * SICRIT® – Soft Ionization by Chemical Reaction In Transfer (Plasmion)
LC/MS, FIA (Flow Injection Analysis), RP-HPLC
* elektrosprejová ionizace (ESI)
* atmosferická chemická ionizace (APCI) * SICRIT® – Soft Ionization by Chemical Reaction In Transfer (Plasmion)
Měření hmotnostních spekter
* nízké (jednotkové) rozlišení - EI+ 70eV
* vysoké rozlišení – přesnost m/z lepší než 5 ppm; (cca 1-2 ppm při použití Lock Mass) – ESI, APCI, SICRIT®
* ESI, APCI - možnost provedení MSn (vícenásobná MS) měření spekter
* EI+ 70 eV, SICRIT® - možnost provedení MS2 měření spekter
Maximální rozsah hmotností při měření hmotnostních spekter
* EI + 70 eV, SICRIT®, APCI: cca 1000 Da - limitováno stabilitou analyzované sloučeniny při převodu do parní fáze
* ESI: 4000 Da (LTQ Orbitrap Velos), 6000 Da (Orbitrap Exploris 240) (uvedeno pro jednonásobně nabité ionty)
Typy analýz
- potvrzení molekulové hmotnosti (návrh nebo potvrzení elementárního složení)
- charakterizace struktury molekuly – MS/MS experimenty, EI+ 70eV
- analýza směsí organických látek (GC/MS)
- analýza směsí organických látek (RP HPLC/MS, RP HPLC/UV-DAD) – po dohodě
- kvantitativní analýzy, screening polutantů v komplexních matricích – po dohodě
- vývoj GC/MS a LC/MS metod (po dohodě), včetně prekoncentračních technik
Výsledky analýz
Výsledky analýz jsou obvykle zasílány na e-mail zadavatele v elektronické formě (hmotnostní spektra a další informace ve formátu pdf popř. vloženy ve formě obrázkového souboru (jpeg, meta file atd.) do souboru MS Word nebo MS Excel. Datové soubory včetně přístrojových dat jsou v laboratoři archivovány obvykle po dobu 3 let, pro individuální vyhodnocování jsou přístrojová data poskytována po dohodě.
Speciální analýzy
Analýzy VOC (těkavých organických látek) v ovzduší a plynech
Analýzy VOC emitovaných z materiálů
k dispozici on-line spojení kanystrový systém - GC/MS a tepelná desorpce (TD) – GC/MS
- odběr vzorků do Tedlarových vaků
- odběr vzorků na tepelně desorbované trubičky (např. TENAX)
- odběr vzorků na rozpouštědlem desorbované trubičky (např. ORBO)
- odběr vzorků na speciální media (např. DNPH)
- odběr vzorků do kanystrů


[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 21841
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /ms
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[25038] => stdClass Object
(
[nazev] => Laboratoř organické elementární analýzy
[seo_title] => Laboratoř OEA
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Typy analýz a jejich omezení
Laboratoř se zabývá stanovením obsahu (hm. %) jednotlivých prvků zejména C, H, N, S, Cl, I, Br, P v dodaných pevných či kapalných vzorcích. Všechny metody, které používáme, jsou založeny na spálení vzorku v proudu kyslíku za vysoké teploty. Vzniklé spaliny jsou pak různými metodami detekovány.
Tyto metody jsou vhodné jak pro čisté organické látky tak i pro vzorky půd, písků, paliv různého původu, rostlinných materiálů a některé anorganické vzorky apod.
Vždy dojde ke spálení vzorku, tedy analýza je desktruktivní.
Jednotlivé typy analýz
Stanovení obsahu C, H, N, S
Pro stanovení obsahu C, H, N, S je používán přístroj Elementar Vario Cube s TCD detekcí, resp. IR detektorem. Toto uspořádání umožňuje stanovení i stopových (pod 100 ppm) množství síry z jedné navážky.
Princip metody:
Základní princip kvantitativního stanovení CHNS je spálení vzorku (organického a mnohých anorganických) pevného i kapalného v proudu kyslíku za vysokých teplot (až 1200°C). Plynné produkty spálení (N2, CO2, H2O a SO2) jsou vyčištěny, odděleny na jednotlivé složky a analyzovány na TCD detektoru.
Omezení:
Obsahuje-li vzorek fluor, nelze u něj stanovit obsah síry a pro tyto vzorky se používá přístroj Elementar EL III, kde je výsledkem obsah C, H, N, S.
Stanovení stopových a semi-stopových obsahů halogenů a síry
Vybavení laboratoře umožňuje i stanovení velmi nízkých obsahů halogenů ve vzorku, kromě fluoru, a velmi nízkých obsahů síry ve vzorcích. Tyto analýzy se provádějí na přístroji Mitsubishi TOX 100.
Princip metody:
Stanovení nízkých obsahů spalitelných halogenů, zejména chloru:
Vzorek je spálen v atmosféře kyslík/argon. Vzniklý HCl je veden do titrační cely, kde je automaticky titrován Ag+, které jsou coulometricky generovány.
Stanovení nízkých obsahů spalitelné síry:
Vzorek je spálen v atmosféře kyslík/argon. Vzniklý SO2 je veden do titrační cely, kde je automaticky titrován I3-.
Omezení:
Stanovení stopového obsahu síry ve vzorku vyžaduje, aby vzorek neobsahoval dusík a halogeny.
Stanovení stopového obsahu halogenů (kromě fluoru) vyžaduje, aby vzorek obsahoval pod 10% S i pod 10% N. Z tohoto omezení vyplývá, že u neznámého vzorku je třeba jako první krok provést analýzu C,H,N,S.
Stanovení obsahu Cl, I, Br
Pro stanovení obsahu Cl, I, Br jsou použity klasické argentometrické analýzy upravené pro malé navážky vzorků. Navážky na jednotlivé analýzy se liší podle předpokládaného obsahu stanovovaného vzorku.
Princip metody:
Vzorek je spálen v Erlenmayerově baňce v nadbytku kyslíku. Spaliny se absorbují do pracovního roztoku H2O2, který se pak kvantitativně převede do titrační baňky. Obsah halogenů se stanoví potenciometrickou titrací za použití odměrného roztoku dusičnanu stříbrného.
Omezení:
Vzorek musí být pevná a snadno spalitelná látka. Je-li obsah stanovovaného prvku do 5%, je potřeba, abyste nám dodali minimálně 100 mg vzorku na jednu analýzu. V případě, že očekávaný obsah prvku je vyšší než 5%, postačuje 20 mg vzorku na jednu analýzu.
Stanovení obsahu fosforu
Fosfor se stanovuje upravenou komplexometrickou odměrnou metodou.
Princip metody:
Vzorek je spálen v atmosféře kyslíku, mineralizován a nepřímou komplexometrickou titrací stanoven obsah fosforu.
Omezení:
Vzorek nesmí obsahovat kovy alkalických zemin. Ke stanovení nízkého obsahu fosforu je potřeba alespoň 800 mg vzorku na jednu analýzu.
Výsledky
Zákazník by měl mít na paměti, že výsledky organické elementární analýzy jsou též ovlivněny vlhkostí analyzovaného vzorku i přítomností zbytkových rozpouštědel.
Výsledky jsou zákazníkovi zasílány elektronickou poštou, na vyžádání v písemné formě.
Stanovení obsahu C, H, N, S
Obsahuje-li vzorek anorganický uhlík (CO32- nebo HCO3-) nebo anorganickou síru (zejména S2- , SO32-, HSO3- a některé SO42-, HSO4- ) pak za podmínek analýzy dojde i ke stanovení těchto prvků, nelze odlišit organicky vázané prvky od anorganicky vázaných.
[iduzel] => 25038
[canonical_url] => //clab.vscht.cz/oea
[skupina_www] => Array
(
)
[url] => /oea
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[24887] => stdClass Object
(
[nazev] => Laboratoř rentgenové difraktometrie a spektrometrie
[seo_title] => Laboratoř RTG
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Laboratoř provádí stanovení fázového složení metodou XRD(X-Ray Diffraction) fázové analýzy spočívající v měření a vyhodnocování difrakčních záznamů a stanovení prvkového složení metodou XRF (X-Ray fluorescence) prvkové analýzy vzorků dodaných ze školních laboratoří, ale i z pracovišť mimo školu. Kromě základních servisních analýz je zde možné provést také nestandardní nebo složitější experimenty, včetně jejich vyhodnocení. Současně s tím v této laboratoři probíhá vědecká a pedagogická činnost, která zahrnuje úzkou spolupráci s dalšími pracovišti na VŠCHT či vědeckými pracovišti i mimo ČR.
Metoda rentgenové práškové difrakce (mineralogická analýza, prášková difrakce) je určena především na měření pevných vzorků (speciální oblastí je možnost studia transformací z pevné do kapalné fáze za vysokých teplot) a je schopna stanovit, zda je vzorek amorfní či krystalický. V případě krystalických vzorků je schopna stanovit přítomnost krystalických fází porovnáním naměřených dat (difraktogramy, powder patterns) s databází PDF-4+ (Powder diffraction file-hlavně anorganika), PDF-4/Organics(organika)
Nejširší využití XRD fázová analýza nalézá v charakterizaci pevných látek, a to jak anorganického, tak i organického původu. Laboratoř se zabývá všemi problémy chemie a chemické technologie mající souvislost s pevnou fází, reakcemi v pevné fázi a heterogenními systémy. Poskytuje informace o průběhu reakce v pevné fázi, o kvalitativním a kvantitativním fázovém složení pevných látek, o krystalických modificích téže sloučeniny, o velikosti elementárních krystalitů(rozsah 1nm-500nm), o stupni krystalinity pevných látek, o strukturní dokonalosti, o textuře a struktuře krystalických materiálů částečně i polymerů. Speciální oblastí je řešení molekulové a krystalové struktury organických látek z monokrystalu či polykrystalického materiálu či vysokoteplotní studium materiálů v rozsahu teplot od 20-1400 oC.
RTG prášková difrakce se stala nepostradatelnou metodou ke studiu korozních procesů, syntézy a studia polovodičových a keramických materiálů, katalyzátoru a farmaceutických preparátů. V případě RTG práškové difrakce se nejedná se o stopovou analýzu, minimální stanovitelná koncentrace krystalické fáze je cca 0.1 hm.%. (Doporučená množství vzorku pro analýzu jsou uvedena v sekci Servis.) Měření je však nedestruktivní a vzorek je možné po analýze dále použít.
V případě XRD mikrodifrakční fázové analýzy se jedná se o analýzu materiálu o množství menším jak 10mg nebo z bodu o velikosti 0.1-2 mm. Lze analyzovat kompaktní vzorky různě křivých tvarů. Nejedná se o stopovou analýzu, minimální stanovitelná koncentrace krystalické fáze je cca 2 hm. %. (Doporučená množství vzorku pro analýzu jsou uvedena v sekci Servis.) Měření je však nedestruktivní a vzorek je možné po analýze dále použít.
Využití XRF metody spočívá ve standardním kvantitativním stanovení prvků F-U v pevných i kapalných vzorkách. Koncentrační rozsah měřených prvků se pohybuje v rozmezí 0.0001 hm.% (1ppm) -100 hm. %. (Doporučená množství vzorku pro analýzu jsou uvedena v sekci Servis.) Měření je však obvykle nedestruktivní(pozor sklo tmavne!) a vzorek je možné po analýze dále použít. Nejrozšířenější aplikací je stanovování prvkového složení skel, jílových materiálů, cementů a kovových slitin.
V případě RTG monokrystalové difrakce se jedná o stanovení struktury malých organických molekul (do 100 nevodíkových atomů v nezávislé části). K měření je nutný monokrystal jehož velikost by se měla pohybovat v rozmezích 100-1000μm v závislosti na složení a velikosti molekuly. V souvislosti s monokrystalovou difrakcí se laboratoř zabývá metodikou přípravy monokrystalů organických látek. Pro pěstování monokrystalu organické látky z roztoku je požadováno cca 50 mg pevného vzorku. Předpokladem úspěšného měření je jeho maximální čistota a dostupné informace o rozpustnosti vzorku v různých rozpouštědlech nebo v jejich soustavách.
Elektronová mikrosonda s rozlišením podle vlnové disperze (WDS) je nepostradatelnou metodou při zjištění přesného bodového chemického složení, kde velikost bodu se pohybuje v jednotkách mikronů. Největších použití dosahuje v geologických vědách, mineralogii a petrologii a rovněž v materiálových vědách. Všude tam, kde je potřeba znát přesné kvantitativní chemické složení bodů na úrovni mikronů, nelze použít žádnou z metod přesné chemické analýzy průměrného složení vzorku (RFA, chemické analytické metody a další), ale právě elektronovou mikrosondu. Ta je v principu elektronovým mikroskopem, od kterého se liší především systémem detekce. Elektronové mikroskopy pracují převážně s energiově disperzním rozlišením - a také počtem krystalových spektrometrů umožňující současné měření více prvků, programováním analýz a množstvím měřených vzorků (počtem vzorků měřených během jednoho měření). Vzorek musí být před měřením zalit do pryskyřice do tablety o průměru 25 mm, naleštěn a před měřením pokoven, nejčastěji uhlíkem. Stejně jako o elektronového mikroskopu lze pozorovat povrch v sekundárních elektronech a fázová rozhraní v odražených elektronech.
[urlnadstranka] =>
[iduzel] => 24887
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /rtg
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[21566] => stdClass Object
(
[nazev] => Pedagogická činnost
[seo_title] => Pedagogická činnost
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Pracovnící Centrálních laboratoří se podílí na výuce předmětů magisterského a doktorského studia. Studenti při výuce získávají rovněž praktické zkušenosti s moderními instrumentálními metodami pro celou řadu vědeckých i průmyslových aplikací.
Příklady předmětů magisterského studia
- NMR pro studium přírodních látek (kód N342010)
- Metody určování struktury látek (kód N108019)
- Molekulové modelování a bioinformatika (kód N320019)
- Analytické metody v památkové péči (kód N148006)
- Metody průzkumu památek (kód N148009)
- Seminář a laboratoř analytiky prostředí (kód N218025)
- Analýza uhlovodíků a životní prostředí (kód N215020)
Příklady předmětů doktorského studia
- Vybrané metody instrumentální analýzy (kód D215006)
- NMR spektroskopie pro studium přírodních látek (kód D342007)
- RTG fázová analýza (kód D108004)
Podrobnější informace naleznete na webových stránkách
jednolivých laboratoří Centrálních laboratoří
Studentského informačního systému VŠCHT
[iduzel] => 21566
[canonical_url] => //clab.vscht.cz/pedagogicke-cinnost
[skupina_www] => Array
(
)
[url] => /pedagogicke-cinnost
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
)
[iduzel] => 20080
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
)
[sablona] => stdClass Object
(
[class] => web
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
[api_suffix] =>
)
DATA
stdClass Object
(
[nazev] => Laboratoř NMR spektroskopie
[seo_title] => NMR
[seo_desc] =>
[autor] =>
[autor_email] =>
[autor_no] =>
[obsah] => Laboratoř NMR spektroskopie je součástí Centrálních laboratoří na Vysoké škole chemicko-technologické v Praze. Jejím hlavním posláním je servisní měření NMR spekter vzorků dodaných ze školních laboratoří, ale i z pracovišť mimo školu. Kromě základních servisních služeb je zde možné provést také nestandardní nebo složitější experimenty, včetně jejich vyhodnocení. Současně s tím v této laboratoři probíhá vědecká a pedagogická činnost, která zahrnuje úzkou spolupráci s dalšími pracovišti na VŠCHT.
Nejširší využití NMR spektroskopie nalézá v charakterizaci látek, převážně organického původu. Laboratoř NMR se kromě určení chemické struktury produktů a meziproduktů reakcí zabývá také stanovením zastoupení složek ve směsích, měřením kinetiky a termodynamiky chemických dějů, kvalitativním posouzením i kvantitativním výpočtem geometrie molekul a dynamikou molekul.
S rozvojem pokročilých technik se NMR spektroskopie stala významnou metodou pro výpočet struktury biomakromolekul – proteinů a nukleových kyselin. V současnosti řešíme prostorové struktury vybraných proteinů Masonova-Pfizerova opičího retroviru.
Ve srovnání s jinými analytickými metodami je NMR spektroskopie méně citlivou metodou, nejedná se o stopovou analýzu. (Doporučená množství vzorku pro analýzu jsou uvedena v sekci Servis.) Měření je však nedestruktivní a vzorek je možné po analýze dále použít
[submenuno] =>
[drobeckyno] =>
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[newurl_domain] => 'clab.vscht.cz'
[newurl_jazyk] => 'cs'
[newurl_akce] => '/nmr'
[newurl_iduzel] => 27634
[newurl_path] => 1/20076/20077/20080/27634
[newurl_path_link] => Odkaz na newurlCMS
[iduzel] => 27634
[platne_od] => 07.06.2016 15:45:00
[zmeneno_cas] => 07.06.2016 15:45:24.852635
[zmeneno_uzivatel_jmeno] => Jan Prchal
[canonical_url] => //clab.vscht.cz/nmr
[idvazba] => 35146
[cms_time] => 1752393398
[skupina_www] => Array
(
)
[slovnik] => Array
(
)
[poduzel] => stdClass Object
(
[27635] => stdClass Object
(
[nazev] => Laboratoř NMR spektroskopie
[seo_title] => Servis
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Upozornění: vzorky změřené po 15. 12. budou zahrnuty do ledna 2018
Servisní měření
Laboratoř je zařízena na měření kapalných vzorků a je schopna zajistit měření širokého spektra prvků. V rámci servisních měření se jedná o prvky 1H, 13C, 15N, 19F a 31P.
Dostupné techniky sahají od jednodimenzionálních po třídimenzionální experimenty, zahrnující až tři různá současně měřená jádra. Pro servisní účely se využívají především základní 1D experimenty, techniky APT, INEPT, DEPT a dále homo- a heteronukleární 2D korelace: 1H– 1H COSY, TOCSY, 1H– 13C/15N HMQC a 1H– 13C/15N HMBC. Další experimenty, využívající například nukleární Overhauserův efekt (NOE), se provádějí po domluvě.
Se vzorkem prosím přineste vyplněný formulář s požadovaným měřením (pdf)
Každý vzorek musí mít unikátní název, jinak hrozí přemazání předchozích dat!
Cena měření
Servisní měření jsou účtována podle přístrojového času podle platného ceníku CL
Orientační doby měření pro jednotlivé experimenty (platí pro standardní malé molekuly v množství cca 15-20 mg):
|
1H
|
1 h
|
|
HMQC
|
2 h
|
|
COSY
|
2 h
|
|
13C APT
|
5 h
|
|
HMBC
|
10 h
|
(Uvedené ceny jsou pouze orientační, potřebná doba měření je závislá na měřené látce a jejím množství)
Přístup k naměřeným spektrům
Spektra přidaná na web ručně (po domluvě) se nacházejí
zde.
Pokud by byl 1. odkaz nedostupný je možné vyzkoušet zálohu zde pouze ftp protokol.
Informace o archivování naměřených spekter Vašich látek a o tom, jak můžete s těmito daty nakládat najdete ZDE.
POZOR! Vaše data uchováváme po naměření pouze 90 dnů.
Poznámka: Data jsou přístupná pouze z počítače, který je v doméně VSCHT.CZ (tj. ne ze soukromých počítačů). Hlavní odkaz je přístupný jak html, tak ftp protokolem, záložní pouze ftp.
Požadavky na úpravu vzorků
Vzorky se měří rozpuštěny v deuterovaných rozpouštědlech, především v CDCl3, DMSO-d6 nebo v D2O. Proto je nutné nejprve vyzkoušet rozpustnost Vaší látky v některém z těchto (i nedeuterovaných) rozpouštědel. Standardní objem je 0,5 ml roztoku.
ROZPUSTNOST PROSÍM OVĚŘTE PRO KONCENTRACE, PŘI KTERÉ BUDE PROBÍHAT MĚŘENÍ!!!
Pro měření 1H spekter je nutná koncentrace vzorku alespoň 10 mmol/l, to znamená cca. 1,5 mg vzorku (molekulová hmotnost 300 g/mol, objem 0,5 ml).
Pro měření 13C spekter je nutná koncentrace vzorku alespoň 20 mmol/l, to je cca. 3,0 mg vzorku (molekulová hmotnost 300 g/mol, objem 0,5 ml).
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[poduzel] => stdClass Object
(
[27637] => stdClass Object
(
[nazev] => FTP archiv naměřených spekter
[seo_title] => archiv
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Všechna spektra naměřená v rámci servisního měření jsou k disposici v našem elektronickém archivu, který je přístupný (anonymní přístup) na adrese
Archivace spekter probíhá automaticky – každý den ve 3:00 jsou všechny experimenty naměřené v den předchozí zabaleny do souboru ve formátu
zip a uloženy do adresáře ftp. Zazipovaná spektra jsou v archivu uchovávána
po dobu 90 dnů, pak jsou
vymazána.
Jména uložených souborů jsou tvořena podle klíče nazevvzorku_N.zip, kde
- nazevvzorku je Vámi uvedené označení analyzovaného vzorku,
- N je číslo experimentu plynoucí z následující tabulky
| 1 až 3 |
1H |
7/10 |
13C nebo APT |
| |
|
51 |
19F |
| 4 |
1H-1H COSY |
52 |
19F (s dekaplingem) |
| 5 |
1H-13C HMQC |
61 |
31P |
| 6 |
1H-13C HMBC |
62 |
31P (s dekaplingem) |
Programy pro zpracování a zobrazování NMR dat
V prostředí MS Windows existuje několik programů pro práci s NMR spektry.
Na VŠCHT je dostupná celoškolní licence pro MNova suit. Instalační soubory pro celoškolní licenci a návod k instalaci najdete na:
https://vc.vscht.cz/software/mnova
Firma Bruker nově uvolnila svůj program Topspin pro akademické pracovníky zdarma. Program je možno po registraci stáhnout ze stránek výrobce.
Krátkyý návod pro instalaci a první použití programu Topspin
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 27637
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/servis/archiv
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[42500] => stdClass Object
(
[nazev] => Návod pro použití programu Topspin
[seo_title] => Návod pro použití programu Topspin
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] => Program Topspin si můžete po registraci stáhnou zdarma ze stránek výrobce (service - software download - nuclear magnetic resonance - free academia license), kde si taktéž vygenerujete licenční klíč, který použijete pro aktivaci programu po instalaci.
Při prvním spuštění budete vyzváni k provedení příkazu expinstall, což udělejte (příkaz cf nedávejte, je určen jen pro počítače připojené ke spektormetru).
Pro nahrání změřených dat do programu topspin je potřeba stažená data rozbalit do následující adresářové struktury:
\nmr\jmenovzorku\N
kde N je číslo experimentu k danému vzorku, doporučujeme používat stejné číslo, jako u komprimovaného archivu na našich stránkách
V cestě nesmí být žádná česká diakritika, mezery a podobné, nejbezpečnější je dát adresář nmr rovnou do kořenu disku.
Poté co adresář nmr vytvoříte v programu Topspin klikněte pravým tlačítkem do pole data, zvolte add new data dir a pomocí tlačítka browse zadejte cestu k adresáři nmr.
Při prvním otevření spektra dojde automaticky k fourierově transformaci. Pro další příkazy použijte manuál, který se nachází pod ikonou otazníku vpravo nahoře.
[iduzel] => 42500
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/servis/topspin
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27693] => stdClass Object
(
[nazev] => Informace
[barva_pozadi] => cervena
[uslideru] => false
[text] =>
[iduzel] => 27693
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => infobox
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
)
[iduzel] => 27635
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/servis
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27767] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[27768] => stdClass Object
(
[nadpis] =>
[popis] =>
[platne_od] =>
[platne_do] =>
[odkaz] => http://clab.vscht.cz/nmr
[text_odkazu] =>
[obrazek_pozadi] => y8lPzwcA.jpg
[barva_textu] =>
[iduzel] => 27768
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => slider
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
)
[iduzel] => 27767
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => slider
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
[27689] => stdClass Object
(
[nazev] => Přístrojové vybavení
[seo_title] => Přístrojové vybavení
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Laboratoř má k dispozici dva pulzní, plně digitální NMR spektrometry pro NMR experimenty v kapalné fázi od firmy Bruker. Starší 500 MHz přístroj byl uveden do provozu v roce 1997. V roce 2008 byl instalován nový přístroj 600 MHz, který je vybaven chlazenou měřící sondou, významně zvyšující jeho citlivost. V roce 2011 byl k původnímu magnetu spektrometru 500 MHz zakoupen nový spektrometr s novými měřicími sondami.
Bruker 600 AvanceIII
Tříkanálový, digitální NMR spektrometr s následujícím vybavením:
- aktivně stíněný, supravodivý magnet UltraShield™ 14,1 T
- digitální konzole
- orthogonální shimovací systém BOSS II s 34 gradienty
- možnost deuteriového dekaplingu
- dvě měřící sondy:
- 5 mm třírezonanční kryosonda TCI (přímé pozorování jader 1H a manipulace s jádry 13C a 15N, s možností deuteriového dekaplingu zvýšená citlivost pro přímé pozorování jader 13C), aktivně stíněný z-gradient
- 5 mm TXI sonda – třírezonanční sonda pro inverzní experimenty (přímé pozorování jader 1H a možností manipulace s jádry 13C a 15N), aktivně stíněný z-gradient

Bruker Avance III™ 500 MHz
Dvoukanálový, digitální NMR spektrometr s následujícím vybavením:
- supravodivý magnet 11,75 T
- digitální konzole AVANCE IIITM
- orthogonální shimovací systém BOSS 3
- gradientová jednotka produkující gradient magnetického pole v ose z
- tři sondy:
- 5 mm BBFO sonda pro přímé pozorování jader 1H, 15N-31P (39-162 MHz) a 19F s dekaplingem jader 1H nebo 19F
- 5 mm BBI sonda – Inversní širokopásmová sonda (přímé pozorování jader 1H) s volitelným jádrem 15N - 31P; možnost aplikace gradientního pulsu ose z
- 10 mm BBO sonda (přímé pozorování jader ve frekvenčním rozsahu 31P–109Ag s možností dekaplingu 1H)

[poduzel] => stdClass Object
(
[27694] => stdClass Object
(
[nazev] => Informace
[barva_pozadi] => cervena
[uslideru] => false
[text] =>
[iduzel] => 27694
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => infobox
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
)
[iduzel] => 27689
[canonical_url] => //clab.vscht.cz/nmr/vybaveni
[skupina_www] => Array
(
)
[url] => /nmr/vybaveni
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27682] => stdClass Object
(
[nazev] => Laboratoř NMR spektroskopie
[seo_title] => Výuka
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Výuka NMR spektroskopie
Laboratoř NMR spektroskopie zajišťuje výuku několika specializačních předmětů na VŠCHT Praha. Podrobnější informace lze nalézt na následujících stránkách jednotlivých předmětů.
NMR spektroskopie pro studium přírodních látek
Metody určování struktury látek – NMR spektroskopie
Moderní instrumentální metody strukturní biologie
Podílíme se rovněž na výuce a organizaci dalších kurzů NMR spektroskopie. Na Matematicko-fyzikální fakultě Karlovy University je to každoroční kurz Moderní problémy NMR spektroskopie v Peci pod Sněžkou.
Princip metody
Nukleární magnetická rezonance (NMR) je jev založený na interakci magneticky aktivních jader (mají nenulový jaderný spin, např. 1H, 13C,...) umístěných v silném magnetickém poli s elektromagnetickým zářením v oblasti radiových vln. Vlivem chemického okolí a vzájemných interakcí sledovaných jader dochází k charakteristickým posunům a štěpením jejich signálů ve spektru. Výsledná spektra je potom možné interpretovat ve smyslu struktury sledované molekuly nebo jejích částí.
Podrobnosti v českém jazyce naleznete na stránkách jednotlivých předmětů (viz výše). V anglickém jazyce viz např.:
NMR spektroskopie přístupná každému...

[urlnadstranka] =>
[obrazek] =>
[poduzel] => stdClass Object
(
[27695] => stdClass Object
(
[nazev] => Informace
[barva_pozadi] => cervena
[uslideru] => false
[text] =>
[iduzel] => 27695
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => infobox
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
[27686] => stdClass Object
(
[nazev] => Metody určování struktury látek – NMR spektroskopie
[seo_title] => Metody určování struktury látek
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Výuka je jednou z pěti volitelných součástí modulového předmětu Metody určování struktury látek (N108019), který probíhá v letním semestru v rozsahu 3 hodin týdně (2 + 1) a je zakončen zkouškou z každého modulu.
S případnými dotazy se na nás můžete obrátit e-mailem (richard.hrabal@vscht.cz) nebo telefonicky (linka 3805); web http://clab.vscht.cz/nmr.
Přednášky ve formátu pdf naleznete na e-lerningovém portálu.
Naším záměrem je umožnit vám lepší orientaci v právě probírané problematice a zjednodušit vytváření poznámek (nebude nutné utrácet čas opisováním prezentací...). Během procvičování interpretace NMR spekter a analýzy složitějších problémů se bez vlastního výtisku spekter neobejdete.
|
Základní pojmy NMR spektroskopie (podstata jevu, NMR parametry...).
Interpretace NMR spekter – využití základních NMR parametrů pro přiřazení 1H NMR spekter.
|
Hrabal
Dvořáková |
|
Vznik NMR signálu a jeho zpracování, základní pulsní sekvence (spinové echo, přenos polarizace...).
Diastereotopicita, posunová činidla. Interpretace 13C NMR spekter.
|
Hrabal
Dvořáková |
|
Dvou a vícedimensionální NMR spektroskopie (homonukleární versus heteronukleární korelační experimenty, klasická versus obrácená detekce, spin-lock).
Přiřazení signálů složitejších molekul, využití dvoudimensionálních experimentů (COSY, HMQC, HMBC). Výpočty spekter, využití databází.
|
Hrabal
Dvořáková |
|
Jaderná spinová relaxace – zavedení, metody měření, relaxační mechanismy, nukleární Overhauserův efekt, příklad měření dynamiky molekuly.
Chemická výměna – vliv na tvar NMR spektra. Metody měření rychlosti chemické výměny – dynamická NMR, výměnná spektrokopie (EXSY) a příklady.
|
Lang
|
|
Nukleární Overhauserův efekt princip měření a jeho využití (diferenční NOE, NOESY, ROESY).
Význam interakční konstanty, Karplusova rovnice, relativní konfigurace na šestičlenných kruzích. Konformace furanosového kruhu – výpočet fázového úhlu a puckering amplitudy. TOCSY.
|
Dvořáková |
Soubory v PDF formátu je možné prohlížet například prostřednictvím programu
Adobe Reader. Příklady k procvičování
|
Doporučená literatura:
|
| H. Friebolin |
Basic One- and Two-Dimensional NMR Spectroscopy |
Wiley-Vch 1998 |
J.K.M. Sanders
B.K. Hunter |
Modern NMR Spectroscopy – a guide for chemists |
Oxford University Press 1994 |
| H. Gunther |
NMR Spectroscopy |
John Wiley 1995 |
R.R. Ernst,
G. Bodenhausen
a A. Wokaun |
Principles of Nuclear Magnetic Resonance in One and Two Dimensions |
Oxford University Press 1987 |
| D. Adams |
The Hitch Hiker's Guide to the Galaxy and The Restaurant at the End of the Universe |
Pan Books 1981, 1982 |
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 27686
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/vyuka/struktura
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27688] => stdClass Object
(
[nazev] => Moderní instrumentální metody strukturní biologie
[seo_title] => Strukturní biologie
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Předmět je zakončen klasifikovaným zápočtem.
Přednášející
| prof. Ing. Richard Hrabal, CSc. |
VŠCHT Praha, místnost A42
tel. 220 443 805, email: hrabalrvscht.cz |
| Ing. Jiří Šantrůček, PhD. |
VŠCHT Praha, místnost BS91
tel. 220 443 216 email: jiri.santrucekvscht.cz |
| doc. Ing. Vojtěch Spiwok, Ph.D. |
VŠCHT Praha, místnost B211
tel. 220 443 028, email: spiwokvvscht.cz |
| Ing. Pavel Ulbrich, PhD. |
VŠCHT Praha, místnost B239
tel. 220 445 168, email: pavel.ulbrichvscht.cz |
| Ing. Jan Prchal, PhD. |
VŠCHT Praha, místnost A42
tel. 220 443 840, email: jan.prchalvscht.cz |
| Ing. Silvie Rimpelová, PhD. |
VŠCHT Praha, místnost B22
tel. 220 443 460, email: rimpelosvscht.cz |
| PharmDr. Jindřiška Angelini, PhD. |
VŠCHT Praha, místnost B232d
tel. 220 443 017, email: jinmatcentrum.cz |
Seznam přednášek
Přednášky jsou přístupné na e-learningovém portálu VŠCHT. Pokud jste studentem zapsaným do tohoto předmětu a nemáte k němu v e-learningu přístup, tak mne kontaktuje.

Soubory v PDF formátu je možné prohlížet například prostřednictvím programu Adobe Reader.

Soubory ve formátu PPT je možné prohlížet například prostřednictvím programu PowerPoint Viewer.
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 27688
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/vyuka/struktbio
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27683] => stdClass Object
(
[nazev] => NMR spektroskopie pro studium přírodních látek
[seo_title] => NMR spektroskopie pro studium přírodních látek
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Předmět (N342010) je určen pro studenty magisterského a doktorského studijního programu. Kurz probíhá v letním semestru v rozsahu 2 hodin týdně a je zakončen klasifikovaným zápočtem (popř. zkouškou pro doktorandy).
S případnými dotazy se na nás můžete obrátit e-mailem (richard.hrabal@vscht.cz) nebo telefonicky (linka 3805); web http://clab.vscht.cz/nmr.
Zadání projektů, přednášky a další příklady k procičování naleznete na e-lerningovém portálu.
Naším záměrem je umožnit vám lepší orientaci v právě probírané problematice a zjednodušit vytváření poznámek (nebude nutné utrácet čas opisováním prezentací...). Během procvičování interpretace NMR spekter a analýzy složitějších problémů se bez vlastního výtisku spekter neobejdete.
|
Základní pojmy NMR spektroskopie (podstata jevu, NMR parametry...). |
Hrabal |
|
Vznik NMR signálu a jeho zpracování, základní pulsní sekvence (spinové echo, přenos polarizace...). |
Hrabal |
|
Dvou a vícedimensionální NMR spektroskopie (homonukleární versus heteronukleární korelační experimenty, klasická versus obrácená detekce, spin-lock). |
Hrabal |
|
Jaderná spinová relaxace – zavedení, metody měření, relaxační mechanismy, nukleární Overhauserův efekt, příklad měření dynamiky molekuly. |
Lang |
|
Interpretace NMR spekter – využití základních NMR parametrů pro přiřazení 1H NMR spekter. |
Dvořáková |
|
Interpretace 13C NMR spekter. Výpočty spekter, využití databází. Přiřazení signálů složitejších molekul, využití dvoudimensionálních experimentů (COSY, HMQC, HMBC). |
Dvořáková |
|
Nukleární Overhauserův efekt – princip měření a jeho využití (diferenční NOE, NOESY, ROESY). TOCSY. |
Dvořáková |
|
Význam interakční konstanty, Karplusova rovnice, relativní konfigurace na šestičlenných kruzích. Konformace furanosového kruhu – výpočet fázového úhlu a puckering amplitudy.
Zadání semestrálního projektu.
|
Dvořáková |
|
Chemická výměna – vliv na tvar NMR spektra. Metody měření rychlosti chemické výměny – dynamická NMR, výměnná spektrokopie (EXSY) a příklady.
|
Lang |
|
NMR spektroskopie biologicky aktivních systémů (struktura a dynamika proteinů a jejich komplexů).
Kvantitativní NMR spektroskopie, NMR a forenzní analýza, ověření pravosti původu/složení potravin měřením zastoupení izotopů (SNIF NMR).
|
Prchal |
|
NMR spektroskopie v pevné fázi. Tvar spektra, kros-polarizace, rotace pod magickým úhlem, příklady.
NMR zobrazování, využití v medicíně. Kódování prostorové informace do NMR signálu, základní pulzní sekvence, kontrast, funkční zobrazování, in vivo spektroskopie.
|
Lang |
Soubory v PDF formátu je možné prohlížet například prostřednictvím programu
Adobe Reader.
|
Doporučená literatura:
|
| H. Friebolin |
Basic One- and Two-Dimensional NMR Spectroscopy |
Wiley-Vch 1998 |
J.K.M. Sanders
B.K. Hunter |
Modern NMR Spectroscopy – a guide for chemists |
Oxford University Press 1994 |
| H. Gunther |
NMR Spectroscopy |
John Wiley 1995 |
R.R. Ernst,
G. Bodenhausen
a A. Wokaun |
Principles of Nuclear Magnetic Resonance in One and Two Dimensions |
Oxford University Press 1987 |
| D. Adams |
The Hitch Hiker's Guide to the Galaxy and The Restaurant at the End of the Universe |
Pan Books 1981, 1982 |
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 27683
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/vyuka/nmr_pl
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
)
[iduzel] => 27682
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/vyuka
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27638] => stdClass Object
(
[nazev] => Laboratoř NMR spektroskopie
[seo_title] => Kontakty + lidé
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Kontakty
Kde nás naleznete:
Vysoká škola chemicko-technologická v Praze, Technická 5, Praha 6.
Laboratoř se nachází v přízemí budovy A, místnost č. 42.
Vedoucí laboratoře
Pracovníci laboratoře
Telefon
+420 220 443 805
+420 220 443 840
+420 220 444 065
Korespondenční adresa:
VŠCHT Praha - Centrální laboratoře
Laboratoř NMR spektroskopie
Technická 5
166 28 Praha 6

[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[poduzel] => stdClass Object
(
[27669] => stdClass Object
(
[nazev] => Ivana Bartošová
[seo_title] => Ivana Bartošová
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
ivana.bartosova@vscht.cz
linka 3805 (tel. 220 443 805)
linka 4065 (tel. 220 444 065)
Vzdělání
|
|---|
| 1976-1980 |
Střední průmyslová škola chemická v Praze ("Křemencárna") |
Zaměstnání
|
|---|
| 1980-1985 |
Vývojový a racionalizační ústav průmyslu papíru a celulózy |
| 1985-1989 |
Ústřední kontrolní a zkušební ústav zemědělský |
| 1989-1991 |
Vojenský ústav hygieny, epidemiologie a mikrobiologie |
| 1995- |
Laboratoř NMR spektroskopie, VŠCHT v Praze |
[iduzel] => 27669
[canonical_url] => //clab.vscht.cz/nmr/kontakty/bartosova
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/bartosova
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[68438] => stdClass Object
(
[nazev] => Ing. Jan Sýkora, Ph.D.
[seo_title] => Ing. Jan Sýkora, Ph.D.
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
sykorab@vscht.cz
linka 3805 (tel. 220 443 805)
ORCID
Vzdělání:
1998 Ing. v oboru chemie silikátů, Fakulta chemické technologie, VŠCHT Praha
2002 Ph.D. v oboru anorganická chemie, Fakulta chemické technologie, VŠCHT Praha
2000 stáž ERASMUS, Evropský membránový institut, Montpellier, Francie
Zaměstnání:
2001 – 2022 vědecký pracovník, Oddělení analytické chemie, Ústav chemických procesů AV ČR,
2006 hostující profesor na ústavu anorganické chemie, Technická univerzita Graz, Rakousko
2023 vědecký pracovník, Laboratoř NMR spektroskopie VŠCHT Praha
Výzkumné zaměření:
Vývoj analytických postupů pro identifikaci organických látek ve složitých matricích pomocí NMR spektroskopie. Analýza směsí syntetických i přírodních organických látek pomocí heteronukleárního NMR, LC-NMR a NMR-omiky. Nevazebné interakce mezi molekulami v pevné fázi a analýza dat z různých typů experimentů rentgenové difrakce jako koníček.
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 68438
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/sykora
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[68068] => stdClass Object
(
[nazev] => Ing. Radim Novotný
[seo_title] => Ing. Radim Novotný
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
radim.novotny@vscht.cz
linka 5173 (tel. 220 445 173)
ORCID
Vzdělání a kvalifikace
2018-
Doktorské studium v oboru Biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha
2017-
Vědecký pracovník v laboratoři NMR spektroskopie, VŠCHT Praha
2016-2018
Magisterské studium v oboru Obecná a Aplikovaná Biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha (téma: Hledání nových interakčních partnerů matrixového proteinu Masonova-Pfizerova opičího viru)
2012-2016
Bakalářské studium v oboru Biochemie a Biotechnologie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha (téma: Cytokompatibilita kovových slitin pro dočasné ortopedické aplikace)
Zaměření v NIVB
Studium struktur a interakcí kapsidových proteinů vybraných flavivirů s částmi virové genomové RNA a membránou endoplazmatického retikula. Preferenční zaměření na kapsidový protein viru klíšťové encefalitidy.
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 68068
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/novotny
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[45400] => stdClass Object
(
[nazev] => Markéta Tichotová
[seo_title] => Markéta Tichotová
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
tichotom@vscht
linka 3840 (tel. 220 443 805
Vzdělání:
2018
Krátkodobá stáž v NMR laboratoři Prof. Dr. C. M. Thiele, Technische Universität Darmstadt, Německo, téma: Thiacalix[4]arene phenoxanthiines - study of constitution, conformation and enantiodiscrimination
2017-
Magisterské studium, obor Organická chemie, Fakulta chemické technologie, VŠCHT Praha
2016
Krátkodobá stáž v laboratoři Dr. J. B. Jebasingh, Karunya University, Indie, téma: Intermediates for molecular imaging
2016 –
Student v laboratoři NMR, VŠCHT Praha
2014-2017
Bakalářské studium, obor Chemie a chemické technologie, Fakulta chemické technologie, VŠCHT Praha, téma: Využití orientujících medií ve strukturní analýze fenoxathiiniových thiacalix[4]arenových derivátů
Oblast výzkum:
Studium malých organických molekul (calix[4]arenů) pomocí NMR spektroskopie, především pomocí metody měření reziduálních dipolárních konstant.
[urlnadstranka] =>
[iduzel] => 45400
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/tichotova
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27696] => stdClass Object
(
[nazev] => Informace
[barva_pozadi] => cervena
[uslideru] => false
[text] =>
[iduzel] => 27696
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => infobox
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
[27677] => stdClass Object
(
[nazev] => Ing. Lukáš Vrzal
[seo_title] => Lukáš Vrzal
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
lukas.vrzal@vscht.cz
linka 3805 (tel. 220 443 805)
-
Vzdělání a kvalifikace
2014
postgraduální studium v oboru Biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha (téma: Vývoj léčiv s využitím malých fragmentů.)
2012-2014
magisterské studium v oboru Analýza léčiv, Fakulta chemicko-inženýrská, VŠCHT Praha (téma: Využití orientujících medií ve strukturní analýze calix[4]arenů.)
-
2009-2012
bakalářské studium v oboru Chemie, Fakulta Chemicko-inženýrská, VŠCHT Praha (téma: Studium prostorové struktury izomerů přemostěného chirálního kalix[4]arenu pomocí reziduálních dipolárních interakcí.
Oblasti výzkumu
Studium struktury malých organických molekul (derivátů calix[n]arenů) pomocí NMR spektroskopie, zejm. s využitím metody měření reziduálních dipolárních interakcí (RDC).
Využití metody Saturation transfer difference (STD) a WaterLOGSY (WL) při vývoji léčiv s využitím knihovny organických fragmentů.
Vybrané publikace
Vrzal L., Flídrová K., Tobrman, T., Dvořáková, H., Lhoták, P., Use of residual dipolar couplings in conformational analysis of meta-disubstituted calix[4]arenes. (2014) Chem. Com., 50(57), 7590-7592.
doi:10.1039/C4CC02274B
Váňa L.; Vrzal L., Dvořáková H., Himl M., Linhart I. Direct arylation of adenine by fluoro- and chloronitrobenzenes. Effect of microwaves. (2013) Synth. Com., 44(6), 788-799.
doi:10.1080/00397911.2013.831902
Holub J., Eigner V., Vrzal L., Dvořáková H., Lhoták P. Calix[4]arenes with intramolecularly bridged meta positions prepared via Pd-catalysed double C-H activation. (2013) Chem. Com., 49(27),2798-2800.
doi:10.1039/c3cc40655e
[iduzel] => 27677
[canonical_url] => //clab.vscht.cz/nmr/kontakty/vrzal
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/vrzal
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27676] => stdClass Object
(
[nazev] => Ing. Tomáš Kroupa
[seo_title] => Ing. Tomáš Kroupa
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
tomas.kroupa@vscht.cz
linka 3840 (tel. 220 443 840)
linka 5173 (tel. 220 445 173)
-
Vzdělání a kvalifikace
-
- 2011-2016
- postgraduální studium v oboru Biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha (téma: Studium interakce nezralých virových částic Masonova-Pfizerova opičího viru s cytoplasmatickou membránou)
- 2011
- magisterské studium v oboru biotechnologie léčiv na VŠCHT Praha (téma: Vliv potenciálních inhibitorů mikrobní adheze na hydrofobitu buněčného povrchu)
-
Oblasti výzkumu
Virologie, studium struktury a funkce proteinů pomocí NMR spektroskopie.
Vybrané publikace
Prchal, J., Kroupa, T., Ruml, T., Hrabal, R. (2014) Interaction of Mason-Pfizer monkey virus matrix protein with plasma membrane. Front. Microbiol. 4(423), doi: 10.3389/fmicb.2013.00423
Kroupa, T., Prchal, J., Doležal, M., Ruml, T., & Hrabal, R. (2014). Cost-effective method for the preparation of uniformly labeled myristoylated proteins for NMR measurements. Protein Expr. Purif., 99, 6-9. doi:10.1016/j.pep.2014.03.005
[iduzel] => 27676
[canonical_url] => //clab.vscht.cz/nmr/kontakty/kroupa
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/kroupa
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27670] => stdClass Object
(
[nazev] => doc. RNDr. Jan Lang, PhD.
[seo_title] => doc. RNDr. Jan Lang, PhD.
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
jan.lang@vscht.cz
Tel.: 22191 2889 (MFF UK)
Odborné zájmy
- spektroskopie nukleární magnetické rezonance a zejména její aplikace založené na relaxaci jaderného spinu
- struktura a dynamika organických supramolekulárních systémů a jejich součástí, zejména na bázi kalixarenu a kryptofanu
- dynamika systémů vodíkových vazeb
- využití NMR spektroskopie pro měření translační difúze tekutin v homogenním i porézním prostředí
- dynamika biologických makromolekul
Odborný životopis
1989 – 1994
Magisterské studium na MFF UK v Praze, obor Fyzika, studijní směr: Fyzika molekulárních a biologických systémů
1994 – 1999
Doktorské studium na MFF UK v Praze, obor Fyzika molekulárních a biologických struktur (disertační práce: NMR study of structure and dynamics of partially rigid organic molecules, školitel: Prof. RNDr. Josef Štěpánek, CSc.).
1997 – 2011
asistent/vědecký pracovník na MFF UK - KFNT 1996 – 2006 odborný/vědecký pracovník na VŠCHT v Praze
2011 habilitace v oboru Fyzika, zaměření Fyzika molekulárních a biologických struktur
od 2011 docent na MFF UK - KFNT STÁŽE
V ZAHRANIČÍ
1993 – 1994
roční studijní pobyt na Kat. fyzikální, anorganické a strukturní chemie Stockholmské univerzity (Prof. J. Kowalewski).
2000
půlroční studijní pobyt na Kat. fyzikální anorganické a strukturní chemie Stockholmské univerzity (Prof. J. Kowalewski).
od 2000
několik kratších pobytů (1 – 4 týdny) na Kat. materiálů a environmentální chemie (původní název Kat. fyzikální anorganické a strukturní chemie) Stockholmské univerzity (Prof. J. Kowalewski).
Seznam publikací
- Bernasek Karel, Grocky Marian, Burian Martin, Lang Jan; Stretched Gelatin Phantom for Detection of Residual Dipolar Couplings in MR Spectra and Data Analysis of Carnosine; Journal of Spectroscopy 2016; 2016;
- Vesely Martin, Bultreys Tom, Peksa Mikulas, Lang Jan, Cnudde Veerle, Van Hoorebeke Luc, Kocirik Milan, Hejtmanek Vladimir, Solcova Olga, Soukup Karel, Gerke Kirill, Stallmach Frank, Capek Pavel; Prediction and Evaluation of Time-Dependent Effective Self-diffusivity of Water and Other Effective Transport Properties Associated with Reconstructed Porous Solids; Transport in Porous Media 110(1); 2015; 81-111;
- Mikuláš Peksa, Sareeya Burrekaew, Rochus Schmid, Jan Lang, Frank Stallmach; Rotational and translational dynamics of \CO2\ adsorbed in \MOF\ Zn2(bdc)2(dabco); Microporous and Mesoporous Materials 216(); 2015; 75 - 81;
- Soltesova Maria, Benda Ladislav, Peksa Mikulas, Czernek Jiri, Lang Jan; Determination of Size of Molecular Clusters of Ethanol by Means of NMR Diffusometry and Hydrodynamic Calculations; JOURNAL OF PHYSICAL CHEMISTRY B 118(24); 2014; 6864-6874;
- Takacs Z., Soltesova M., Kowalewski J., Lang J., Brotin T., Dutasta J. -P.; Host-guest complexes between cryptophane-C and chloromethanes revisited; MAGNETIC RESONANCE IN CHEMISTRY 51(1); 2013; 19-31;
- Takacs Zoltan, Brotin Thierry, Dutasta Jean-Pierre, Lang Jan, Todde Guido, Kowalewski Jozef; Inclusion of Chloromethane Guests Affects Conformation and Internal Dynamics of Cryptophane-D Host; JOURNAL OF PHYSICAL CHEMISTRY B 116(27); 2012; 7898-7913;
- Divisova Hana, Lang Jan, Rotter Milos, Schmoranzer David; MEASUREMENT OF VISCOSITY IN SMALL VOLUMES OF FLUIDS BY TUNING FORK OSCILLATORS; EFM11 - EXPERIMENTAL FLUID MECHANICS 2011 25; 2012;
- Mackova Michaela, Himl Michal, Minarova Lenka, Lang Jan, Lhotak Pavel; Regioselective deuteration of 25 27-dialkoxycalix[4]arenes; TETRAHEDRON LETTERS 52(20); 2011; 2543-2546;
- Srb Pavel, Vlach Jiri, Prchal Jan, Grocky Marian, Ruml Tomas, Lang Jan, Hrabal Richard; Oligomerization of a Retroviral Matrix Protein Is Facilitated by Backbone Flexibility on Nanosecond Time Scale; JOURNAL OF PHYSICAL CHEMISTRY B 115(11); 2011; 2634-2644;
- Herynkova Katerina, Kusova Katerina, Cibulka Ondrej, Pelant Ivan, Lang Jan; SILICON NANOCRYSTALS WITH ORGANIC PASSIVATION: MORE EFFICIENT LUMINESCENCE FROM SILICON;; 2011; 18-24;
- Kusova Katerina, Cibulka Ondrej, Dohnalova Katerina, Pelant , Valenta Jan, Fucikova Anna, Zidek Karel, Lang Jan Englich Jiri, Matejka Pavel, Stepanek Petr, Bakardjieva Snejana; Brightly Luminescent Organically Capped Silicon Nanocrystals Fabricated at Room Temperature and Atmospheric Pressure; ACS NANO 4(8); 2010; 4495-4504;
- Takacs Z., Soltesova M., Kotsyubynskyy D., Kowalewski J., Lang J., Brotin T., Dutasta J. P.; NMR investigation of guest-host complex between chloroform and cryptophane C; MAGNETIC RESONANCE IN CHEMISTRY 48(8); 2010; 623-629;
- Dolensky Bohumil, Kvicala Jaroslav, Paleta Oldrich, Lang Jan, Dvorakova Hana, Cejka Jan; Trifluoromethylated (tetrahydropyrrolo) quinazolinones by a new reaction and facile assignment of the regio- and stereoisomers formed by NMR spectroscopy; MAGNETIC RESONANCE IN CHEMISTRY 48(5); 2010; 375-385;
- Vlach Jiri, Srb Pavel, Prchal Jan, Grocky Marian, Lang Jan, Ruml Tomas, Hrabal Richard; Nonmyristoylated Matrix Protein from the Mason-Pfizer Monkey Virus Forms Oligomers; JOURNAL OF MOLECULAR BIOLOGY 390(5); 2009; 967-980;
- Brauer Gerhard, Anwand Wolfgang, Grambole Dieter, Egger , Sperr Peter, Beinik Igor, Wang Lin, Teichert , Kuriplach Jan, Lang Jan, Zviagins Sergei, Erik, Ling Chi Chung, Hsu Yuk Fan, Xi Yan Yan, Chen Xinyi, Djurisic Aleksandra B., Skorupa Wolfgang; Characterization of ZnO nanostructures: A challenge to positron annihilation spectroscopy and other methods; 6(11); 2009; 2556-2560;
- Vlach Jiri, Lipov Jan, Rumlova Michaela, Veverka Vaclav, Jan, Srb Pavel, Knejzlik Zdenek, Pichova Iva, Hunter Eric, Hrabal Richard, Ruml Tomas; D-retrovirus morphogenetic switch driven by the targeting signal accessibility to Tctex-1 of dynein; PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA 105(30); 2008; 10565-10570;
- Lang Jan, Dybal Jiri, Makrlik Emanuel, Vanura Petr, Vasickova Sona, Malon Petr; Extraction and DFT study on the complexation of H3O+ with hexaethyl p-tert-butylcalix[6]arene hexaacetate; JOURNAL OF MOLECULAR STRUCTURE 846(1-3); 2007; 157-160;
- Dvorakova Hana, Lang Jan, Vlach Jiri, Sykora Jan, Cajan , Himl Michal, Pojarova Michaela, Stibor Ivan, Lhotak Pavel; Partially O-Alkylated thiacalix[4]arenes: Synthesis molecular and crystal structures conformational behavior; JOURNAL OF ORGANIC CHEMISTRY 72(19); 2007; 7157-7166;
- Kriz Jaroslav, Dybal Jiri, Makrlik Emanuel, Vanura Petr, Lang Jan; A proton complex of p-tert-butylcalix[4]arene-tetrakis (N N-dimethylthioacetamide): NMR evidence and probable structure; SUPRAMOLECULAR CHEMISTRY 19(6); 2007; 419-424;
- Dybal J., Makrlik E., Vanura P., Lang J.; A combined experimental and theoretical study on the complexation of H3O+ with hexaethyl calix[6]arene hexaacetate; ZEITSCHRIFT FUR PHYSIKALISCHE CHEMIE-INTERNATIONAL JOURNAL OF RESEARCH IN PHYSICAL CHEMISTRY \& CHEMICAL PHYSICS 221(4); 2007; 519-525;
- Lang J, Vagnerova K, Czernek J, Lhotak P; Flip-flop motion of circular hydrogen bond array in thiacalix[4]arene; SUPRAMOLECULAR CHEMISTRY 18(4); 2006; 371-381;
- Lang J, Deckerova V, Czernek J, Lhotak P; Dynamics of circular hydrogen bond array in calix[4]arene in a nonpolar solvent: A nuclear magnetic resonance study; JOURNAL OF CHEMICAL PHYSICS 122(4); 2005;
- Veverka V, Bauerova H, Zabransky A, Lang J, Ruml T, Pichova I, Hrabal R; Three-dimensional structure of a monomeric form of a retroviral protease; JOURNAL OF MOLECULAR BIOLOGY 333(4); 2003; 771-780;
- Lang J, Tosner Z, Lhotak P, Kowalewski J; Reorientational dynamics of two isomers of thiacalix[4]arene; MAGNETIC RESONANCE IN CHEMISTRY 41(10); 2003; 819-827;
- Lhotak P, Himl M, Stibor I, Sykora J, Dvorakova H, Lang J, Petrickova H; Conformational behaviour of tetramethoxythiacalix[4]arenes: solution versus solid-state study; TETRAHEDRON 59(38); 2003; 7581-7585;
- Tosner Z, Lang J, Sandstrom D, Petrov O, Kowalewski J; Dynamics of an inclusion complex of dichloromethane and cryptophane-E; JOURNAL OF PHYSICAL CHEMISTRY A 106(38); 2002; 8870-8875;
- Cajan M, Lhotak P, Lang J, Dvorakova H, Stibor I, Koca J; The conformational behaviour of thiacalix[4]arenes: the pinched cone-pinched cone transition; JOURNAL OF THE CHEMICAL SOCIETY-PERKIN TRANSACTIONS 2(11); 2002; 1922-1929;
- Lang J, Dechter JJ, Effemey M, Kowalewski J; Dynamics of an inclusion complex of chloroform and cryptophane-E: Evidence for a strongly anisotropic van der Waals bond; JOURNAL OF THE AMERICAN CHEMICAL SOCIETY 123(32); 2001; 7852-7858;
- Lang J, Vlach J, Dvorakova H, Lhotak P, Himl M, Hrabal R, Stibor I; Thermal isomerisation of isolation of all four conformers; JOURNAL OF THE CHEMICAL SOCIETY-PERKIN TRANSACTIONS 2(4); 2001; 576-580;
- Effemey M, Lang J, Kowalewski J; Multiple-field carbon-13 and proton relaxation in sucrose in viscous solution; MAGNETIC RESONANCE IN CHEMISTRY 38(12); 2000; 1012-1018;
- Lhotak P, Kaplanek L, Stibor I, Lang J, Dvorakova H, Hrabal R, Sykora J; NMR and X-ray analysis of 25 27-dimethoxythiacalix[4] arene: unique infinite channels in the solid state; TETRAHEDRON LETTERS 41(48); 2000; 9339-9344;
- Czernek J, Lang J, Sklenar V; Ab initio calculations of spin-spin coupling constants in anhydrodeoxythymidines; JOURNAL OF PHYSICAL CHEMISTRY A 104(12); 2000; 2788-2792;
- Lang J, Chmelova K, Stepanek J, Kowalewski J, Holy A; Applicability of spectroscopic methods in the investigation of metal cation binding to adenine mononucleotides and their analogues; JOURNAL OF MOLECULAR STRUCTURE 481(SI); 1999; 363-367;
- Lang J, Dvorakova H, Bartosova I, Lhotak P, Stibor I, Hrabal R; Conformational flexibility of a novel tetraethylether of A comparison with the classical methylene-bridged compounds; TETRAHEDRON LETTERS 40(2); 1999; 373-376;
- Stepanek J, Kowalewski J, Lang J, Mojzes P; Spectroscopic investigation of nickel cation binding with adenine stability and structure of the 1 : 2 complex with adenosine 5 -monophosphate; JOURNAL OF BIOLOGICAL INORGANIC CHEMISTRY 3(5); 1998; 543-556;
- MALER L, LANG J, WIDMALM G, KOWALEWSKI J; MULTIPLE-FIELD C-13 NMR RELAXATION INVESTIGATION ON MELEZITOSE; MAGNETIC RESONANCE IN CHEMISTRY 33(7); 1995; 541-548;
[iduzel] => 27670
[canonical_url] => //clab.vscht.cz/nmr/kontakty/lang
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/lang
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27667] => stdClass Object
(
[nazev] => Ing. Hana Dvořáková, CSc.
[seo_title] => Ing. Hana Dvořáková, CSc.
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
hana.dvorakova@vscht.cz 
linka 3840 (tel. 220 443 840)
-
Vzdělání a kvalifikace
-
- 1991
- titul CSc. v oboru organická chemie na Ústavu organické chemie a biochemie Československé akademie věd (téma: Acyklická analoga nukleosidů a nukeotidů s modifikovanými purinovými basemi)
- 1978
- titul Ing. v oboru organická chemie na VCHT Praha (téma: Elektrochemické oxidace benzofuranů)
- Zaměstnání
-
- 1996–
- vědecký pracovník v laboratoři NMR, VCHT Praha
- 1994
- jednoroční pobyt na Organic Chemistry Department of the University of Leicester, GB
- 1983–1995
- vědecký pracovník v Ústavu organické chemie a biochemie Československé akademie věd
Oblasti výzkumu
Aplikace NMR spektroskopie v oblasti kalixarenů, resorcinarenů a přírodních látek. Studium konformačních vlastností a dynamiky molekul, kinetika a termodynamika chemických reakcí.
Vybrané publikace
Lukášek, J.; Böhm, S.; Dvořáková, H.; Eigner, V.; Lhoták, P., Regioselective Halogenation of Thiacalix[4]arenes in the Cone and 1,3-Alternate Conformations, (2014) Org. Lett. 16, asap doi: 10.1021/ol5024536
Slavik, P.; Dvořáková, H.; Eigner, V.; Lhoták, P., Regioselective Alkylation of a Methylene Group via meta-bridging Calix[4]arenes (2014) Chem. Commun. 50, 10112-10114 doi:10.1039/C4CC04356A
Botha, F.; Böhm, S.; Dvořáková, H.; Eigner, V.; Lhoták, P., Mercuration of Thiacalix[4]?arenes in the Cone and 1,?3-?Alternate Conformations (2014)Org. Biomol. Chem. 12, 5136-5143 doi:10.1039/C4OB00799A
Vrzal L., Flídrová K., Tobrman, T., Dvořáková, H., Lhoták, P., Use of residual dipolar couplings in conformational analysis of meta-disubstituted calix[4]arenes. (2014) Chem. Com., 50(57), 7590-7592.
10.1039/C4CC02274B
Holub J., Eigner V., Vrzal L., Dvořáková H., Lhoták P. Calix[4]arenes with intramolecularly bridged meta positions prepared via Pd-catalysed double C-H activation. (2013) Chem. Com., 49(27),2798-2800. doi:10.1039/c3cc40655e
Váňa L.; Vrzal L., Dvořáková H., Himl M., Linhart I. Direct arylation of adenine by fluoro- and chloronitrobenzenes. Effect of microwaves. (2013) Synth. Com., 44(6), 788-799.doi:10.1080/00397911.2013.831902
Flidrova K., Bohm S., Dvorakova H., Eigner V., Lhotak P. (2014) Dimercuration of Calix[4]arenes: Novel Substitution Pattern in Calixarene Chemistry, Organic Letters, 16(1), 138-141. doi:10.1021/ol403133b
Menova P., Dvorakova H., Eigner V., Ludvik J., Cibulka R. (2013) Electron-Deficient Alloxazinium Salts: Efficient Organocatalysts of Mild and Chemoselective Sulfoxidations with Hydrogen Peroxide, Advanced Synthesis & Catalysis, 355(17), 3451-3462. doi:10.1002/adsc.201300617
Jurok R., Hodacova J., Eigner V., Dvorakova H., Setnicka V., Cibulka R. (2013) Planar Chiral Flavinium Salts: Synthesis and Evaluation of the Effect of Substituents on the Catalytic Efficiency in Enantioselective Sulfoxidation Reactions, European Journal of Organic Chemistry, 2013(34), 7724-7738. doi:10.1002/ejoc.201300847
Slavik P., Flidrova K., Dvorakova H., Eigner V., Lhotak P. (2013) Meta-arylation of calixarenes using organomercurial chemistry, Organic & Biomolecular Chemistry, 11(33), 5528-5534. doi:10.1039/c3ob41085d
Benesova E., Lipovova P., Dvorakova H. Kralova B. (2013) ?-L-Fucosidase from Paenibacillus thiaminolyticus: Its hydrolytic and transglycosylation abilities, Glycobiology, 23(9), 1052-1065. doi:10.1093/glycob/cwt041
Flidrova K., Slavik P., Eigner V,; Dvorakova H., Lhotak P. (2013) meta-Bridged calix[4]arenes: a straightforward synthesis via organomercurial chemistry, Chemical Communications, 49(60), 6749-6751. doi:10.1039/c3cc43284j
Holub J., Eigner V., Vrzal L., Dvorakova H., Lhotak P. (2013) Calix[4]arenes with intramolecularly bridged meta positions prepared via Pd-catalysed double C-H activation, Chemical Communications, 49(27), 2798-2800. doi:10.1039/c3cc40655e
Jurasek M., Dzubak P., Sedlak D., Dvorakova H., Hajduch M., Bartunek P., Drasar P. (2013) Preparation, preliminary screening of new types of steroid conjugates and their activities on steroid receptors. Steroids, 78(3), 356-361. doi:10.1016/j.steroids.2012.11.016
Mackova M., Himl M., Budka J., Pojarova M., Cisarova I., Eigner V., Curinova P., Dvorakova H., Lhotak P. (2013) Self-assembly of 5,11,17,23-tetranitro-25,26,27,28-tetramethoxythiacalix[4]arene with neutral molecules and its use for anion recognition. Tetrahedron, 69(4), 1397-1402. doi:10.1016/j.tet.2012.10.101
Hudecek O., Budka J., Dvorakova H., Curinova P., Cisarova I., Lhotak P. (2013) Anion receptors based on ureidocalix[4]arenes immobilised in the partial cone conformation. New Journal of Chemistry, 37(1), 220-227. doi:10.1039/c2nj40724h
Koukal, P., Dvorakova, H., Dvorak, D., Tobrman, T. (2013) Palladium-catalysed Claisen rearrangement of 6-allyloxypurines. Chemical Papers, 67(1), 3-8. doi:10.2478/s11696-012-0239-y
Tatar A., Dolensky B., Dvorakova H., Kral V. (2012) Selective formation of either Troeger's base or spiro Troeger's base derivatives from [2-aminoporphyrinato(2-)]nickel by choice of reaction condition. Tetrahedron Letters, 53(45), 6015-6017. doi:10.1016/j.tetlet.2012.08.097
Krovacek M., Dvorakova H., Votruba I., Cisarova I., Dvorak D. (2012) 6-Alkynylpurines bearing electron acceptor substituents: preparation, reactivity in cycloaddition reactions and cytostatic activity. Collection of Czechoslovak Chemical Communications, 76(12), 1487-1507. doi:10.1135/cccc2011176
Kundrat O., Dvorakova H., Bohm S., Eigner V., Lhotak P. (2012) S-Alkylation of Thiacalixarenes: How the Regio- and Stereoselectivities Depend on the Starting Conformation. Journal of Organic Chemistry, 77(5), 2272-2278. doi:10.1021/jo202571h
Kaminsky J., Dvorakova H., Stursa J., Moravcova J. (2011) Collection of Czechoslovak Chemical Communications, 76(10), 1199-1222. doi:10.1135/cccc2010104
Menova P., Eigner V., Cejka J., Dvorakova H., Sanda M., Cibulka R. (2011) Synthesis and structural studies of flavin and alloxazine adducts with O-nucleophiles. Journal of Molecular Structure, 1004(1-3), 178-187. doi:10.1016/j.molstruc.2011.08.002
Kundrat O., Eigner V., Dvorakova H., Lhotak P. (2011) S-Alkylation of Thiacalixarenes: A Long-Neglected Possibility in the Calixarene Family. Organic Letters, 13(15), 4032-4035. doi:10.1021/ol201546y
Menova P., Kafka F., Dvorakova H., Gunnoo S., Sanda M., Cibulka R. (2011) Pyrazinium Salts as Efficient Organocatalysts of Mild Oxidations with Hydrogen Peroxide. Advanced Synthesis & Catalysis. 353(6), 865-870. doi:10.1002/adsc.201000906
Jurok R., Cibulka R., Dvorakova H., Hampl F., Hodacova J. (2010) Planar Chiral Flavinium Salts - Prospective Catalysts for Enantioselective Sulfoxidation Reactions. European Journal of Organic Chemistry. (27), 5217-5224 doi:10.1002/ejoc.201000592
Chlubnova I., Filipp D., Spiwok V., Dvorakova H., Daniellou R., Nugier-Chauvin Caroline,. Kralova B., Ferrieres V. (2010) Enzymatic synthesis of oligo-D-galactofuranosides and L-arabinofuranosides: from molecular dynamics to immunological assays. Organic & Biomolecular Chemistry. 8(9), 2092-2102. doi:10.1039/b926988f
Dolensky B., Kvicala J., Paleta O., Lang J., Dvorakova H., Cejka J. (2010) Trifluoromethylated (tetrahydropyrrolo) quinazolinones by a new three-component reaction and facile assignment of the regio- and stereoisomers formed by NMR spectroscopy. Magnetic Resonance in Chemistry, 48(5), 375-385. doi:10.1002/mrc.2580
Benesova E., Lipovova P., Dvorakova H., Kralova B. (2010) ß-d-Galactosidase from Paenibacillus thiaminolyticus catalyzing transfucosylation reactions. Glycobiology, 20(4), 442-451. doi:10.1093/glycob/cwp196
Hornicek J., Dvorakova H., Bour P. (2010) Intramolecular Proton Transfer in Calixphyrin Derivatives. Journal of Physical Chemistry A, 114(10), 3649-3654. doi:10.1021/jp911598w
Zurek J., Cibulka R., Dvorakova H., Svoboda J. (2010) N 1,N 10-Ethylene-bridged flavinium salts derived from -valinol: synthesis and catalytic activity in H2O2 oxidations. Tetrahedron Letters, 51(7), 1083-1086. doi:10.1016/j.tetlet.2009.12.096
Kundrat O., Dvorakova H., Eigner V., Lhotak P. (2010) Uncommon Regioselectivity in the Thiacalix[4]arene Series: Gross Formylation of the Cone Conformer. Journal of Organic Chemistry, 75(2), 407-411. doi:10.1021/jo902240h
Kundrat, O., Dvorakova, H., Cisarova, I., Pojarova, M., Lhotak, P. (2009) Org. Lett. 11, 4188-4191. doi:10.1021/ol901812m
Keder, R., Dvorakova, H., Dvorak, D. (2009) Eur. J. Org. Chem. 1522-1531. doi:10.1002/ejoc.200801002
Simanova, M., Dvorakova, H., Stibor, I., Pojarova, M., Lhotak, P. (2008) Tetrahedron Lett. 49, 1026-1029. doi:10.1016/j.tetlet.2007.12.004
Dvorakova, H., Lang, J., Vlach, J., Sykora, J., Cajan, M., Himl, M., Pojarova, M., Stibor, I., Lhotak, P. (2007) J. Org. Chem. 72, 7157-7166. doi:10.1021/jo070927i
Tobrman, T., Meca, L., Dvorakova, H., Cerny, J., Dvorak, D. (2006) Organometallics 25, 5540-5548. doi:10.1021/om0605837
Dvorakova, H., Stursa, J., Cajan, M., Moravcova, J. (2006) Eur. J. Org. Chem. 4519-4527. doi:10.1002/ejoc.200600386
Bernatkova, M., Dvorakova, H., Andrioletti, B., Kral, V., Bour, P. (2005) J. Phys. Chem. A 109, 5518-5526. doi:10.1021/jp050746p
Dolensky, B., Kroulik, J., Kral, V., Sessler, J. L., Dvorakova, H., Bour, P., Bernatkova, M., Bucher, C., Lynch, V. (2004) J. Am. Chem. Soc. 126, 13714-13722. doi:10.1021/ja048075g
Novak, J., Linhart, I., Dvorakova, H. (2004) Eur. J. Org. Chem. 2738-2746. doi:10.1002/ejoc.200300811
Stastny, V., Stibor, I., Dvorakova, H., Lhotak, P. (2004) Tetrahedron 60, 3383-3391. doi:10.1016/j.tet.2004.02.036
Stursa, J., Dvorakova, H., Smidrkal, J., Petrickova, H., Moravcova, J. (2004) Tetrahedron Lett. 45, 2043-2046. doi:10.1016/j.tetlet.2004.01.080
Lhotak, P., Himl, M., Stibor, I., Sykora, J., Dvorakova, H., Lang, J., Petrickova, H. (2003) Tetrahedron 59, 7581-7585. doi:10.1016/S0040-4020(03)01171-2
Hocek, M. Dvorakova, H. (2003) J. Org. Chem. 68, 5773-5776. doi:10.1021/jo034351i
Dvorakova, H., Masojidkova, M., Holy, A., Balzarini, J., Andrei, G., Snoeck, R., DeClercq, E. (1996) J. Med. Chem. 39, 3263-3268. doi:
Dvorakova, H., Dvorak, D., Holy, A. (1996) Tetrahedron Lett. 37, 1285-1288.
[iduzel] => 27667
[canonical_url] => //clab.vscht.cz/nmr/kontakty/dvorakova
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/dvorakova
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27668] => stdClass Object
(
[nazev] => Ing. Jan Prchal, PhD.
[seo_title] => Ing. Jan Prchal, PhD.
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
 jan.prchal@vscht.cz
jan.prchal@vscht.cz
linka 3840 (tel. 220 443 840)
linka 5173 (tel. 220 445 173)
Researcher ID
-
ORCID
Vzdělání a kvalifikace
- 2014
- Krátkodobá stáž v laboratoři Dr. Delphine Muriaux, CPBS, CMRS, Montpellier, Francie
- 2010-
- vědecký pracovník v laboratoři NMR spektroskopie, VŠCHT Praha
- 2007–2013
- postgraduální studium v oboru Biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha (téma: Studie interakce matrixového proteinu Masonova-Pfizerova opičího viru s cytoplasmatickou membránou)
- 2002–2007
- magisterské studium v oboru Obecná a Aplikovaná Biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha (téma: Studium struktury mutantu T41I/T78I matrixového proteinu Mason-Pfizerova opičího viru)
Oblasti výzkumu
Virologie, studium struktury a funkce proteinů pomocí NMR spektroskopie.
Vybrané publikace
Vlach J., Srb P., Prchal J., Grocký M., Lang J., Ruml T., Hrabal R. (2009) Nonmyristoylated Matrix Protein from the Mason-Pfizer Monkey Virus Forms Oligomers. J. Mol. Biol., 390(5), 967–980. doi:10.1016/j.jmb.2009.05.063
Srb P., Vlach J., Prchal J., Grocký M., Ruml T., Lang J., Hrabal R. (2011) Oligomerization of a retroviral matrix protein is facilitated by backbone flexibility on nanosecond time scale. J. Phys. Chem. B, 115(11), 2634-2644.doi: 10.1021/jp110420m
Prchal J., Junková P., Strmisková M., Lipov J., Hynek R., Ruml T., Hrabal R. (2011) Expression and purification of myristoylated matrix protein of Mason-Pfizer monkey virus for NMR and MS measurements. Protein Expr. Purif., 79(1), 122-127. doi: 10.1016/j.pep.2011.05.010
Prchal, J., Srb, P., Hunter, E., Ruml, T., Hrabal, R. (2012)The Structure of Myristoylated Mason-Pfizer Monkey Virus Matrix Protein and the Role of Phosphatidylinositol-(4,5)-bisphosphate in its Membrane Binding. J.Mol.Biol., 423(3), 427-438. doi:10.1016/j.jmb.2012.07.021
Junkova, P., Vermachova, M., Prchal, J., Kuckova, S., Hrabal, R., Hynek, R. (2013) Improved Approach for the Labeling of Argininne, Glutamic, and Aspartic Acid Side Chains in Proteins Using Chromatographic Techniques. J. Liq. Chromatogr. Relat. Technol., 36(9), 1221-1230. doi:10.1080/10826076.2012.685918
Rozbeský, D., Krejzová, J., Křenek, K., Prchal, J., Hrabal, R., Kožíšek, M., Weignerová, L., Fiore, M., Dumy, P., Křen, V., Renaudet, O. (2014) Re-Evaluation of Binding Properties of Recombinant Lymphocyte Receptors NKR-P1A and CD69 to Chemically Synthesized Glycans and Peptides. Int. J. Mol. Sci., 15(1), 1271-1283. doi:10.3390/ijms15011271
Prchal, J., Kroupa, T., Ruml, T., Hrabal, R. (2014) Interaction of Mason-Pfizer monkey virus matrix protein with plasma membrane. Front. Microbiol. 4(423), doi: 10.3389/fmicb.2013.00423
Kroupa, T., Prchal, J., Doležal, M., Ruml, T., & Hrabal, R. (2014). Cost-effective method for the preparation of uniformly labeled myristoylated proteins for NMR measurements. Protein Expr. Purif., 99, 6-9. doi:10.1016/j.pep.2014.03.005
Junková, P., Prchal, J., Spiwok, V., Pleskot, R., Kadlec, J., Krásný, L., Hynek, R., Hrabal, R. and Ruml, T. (2016), Molecular aspects of the interaction between Mason—Pfizer monkey virus matrix protein and artificial phospholipid membrane. Proteins, 84: 1717–1727. doi:10.1002/prot.25156
Kerviel A, Dash S, Moncorgé O, Panthu B, Prchal J, Décimo D, et al. (2016) Involvement of an Arginine Triplet in M1 Matrix Protein Interaction with Membranes and in M1 Recruitment into Virus-Like Particles of the Influenza A(H1N1)pdm09 Virus. PLoS ONE 11(11): e0165421. doi:10.1371/journal.pone.0165421
Kroupa T., Langerová H., Doležal M., Prchal J., Spiwok V., Hunter E., Rumlová M., Ruml T., Hrabal R. (2016), Membrane Interactions of the Mason-Pfizer Monkey Virus Matrix Protein and Its Budding Deficient Mutants. J.Mol.Biol. 428(23):4708-4722. doi: 10.1016/j.jmb.2016.10.010.
JUNKOVA, P.; PLESKOT, R.; PRCHAL, J.; SYS, J. et al. Differences and commonalities in plasma membrane recruitment of the two morphogenetically distinct retroviruses HIV-1 and MMTV (vol 295, pg 8819, 2020). Journal of Biological Chemistry, 295, n. 31, p. 10869-10869, Jul 2020. DOI: 10.1074/JBC.AAC120.015073
PRCHAL, J.; SYS, J.; JUNKOVA, P.; LIPOV, J. et al. Interaction Interface of Mason-Pfizer Monkey Virus Matrix and Envelope Proteins. Journal of Virology, 94, n. 20, Oct 2020. DOI:10.1128/JVI.01146-20
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 27668
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/prchal
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27666] => stdClass Object
(
[nazev] => prof. Ing. Richard Hrabal, CSc.
[seo_title] => prof. Ing. Richard Hrabal, CSc.
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
richard.hrabal@vscht.cz
linka 3805 (tel. 220 443 805)
Orcid
-
Vzdělání a kvalifikace
-
- 2017
- Jmenován profesorem biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha.
- 2007
- Habilitace v oboru biochemie, Fakulta potravinářské a biochemické technologie, VŠCHT Praha.
- 1989
- CSc. v oboru organická chemie, Fakulta chemické technologie VŠCHT Praha
- 1988
- Postgraduální kurs "NMR spektroskopie v kapalné a pevné fázi", Fakulta chemickej technológie, Slovenská vysoká škola technická v Bratislavě
- 1982
- Ing. v oboru organická chemie, Fakulta chemické technologie, VŠCHT Praha
- Zaměstnání
-
- 2003–
- vedoucí Centrálních laboratoří VŠCHT Praha
- 1996–
- vedoucí Laboratoře NMR spektroskopie na VŠCHT Praha
- 1993–1996
- Research Associate na Biotechnology Research Institute, div. Biomolecular Interactions. National Research Council of Canada, Montreal, Canada
- 1992–1993
- vedoucí laboratoře NMR, VŠCHT Praha
- 1990
- krátkodobý studijní pobyt na Inorganic Chemistry Department of the Oxford University, Prof. R.J.P. Williams (Study of binding zinc ion to short peptides)
- 1987–1992
- odborný pracovník v NMR laboratoři
- 1986–1987
- vědecký pracovník na Katedře organické chemie VŠCHT Praha
Oblasti výzkumu
Aplikace NMR spektroskopie s vysokým rozlišením v chemii, biochemii a molekulární biologii. Molekulové modelování, především pro zkoumání struktury peptidů, proteinů a jejich komplexů.
Vybrané publikace
Šebek P., Nešpůrek S., Hrabal R., Adamec M., Kuthan J.: Novel Preparation Photochromic Properties of 2,4,4,6-tetraaryl-4H-thiopyrans. J.Chem. Soc.-Perkin Trans 2 1301-1308 (1992) [IF 1.863, cited 34]
Srinivasan J., Hu S., Hrabal R., Zhu Y., Komives E.A., Ni F.: Thrombin-Bound Structure of an EGF Subdomain from Human Thrombomodulin Determined by Tranferred Nuclear Overhauser Effect. Biochemistry 33, 13553 (1994) [IF 3.922, cited 28]
Hrabal R., Komives. E.A., Ni F.: Structure Resiliency of an EGF-like Subdomain Bound to its Target Protein, Thrombin. Protein Science, 5, 195 (1996) [IF 3.787, cited 20]
Lang J., Dvořáková H., Bartošová I., Lhoták P., Stibor I., Hrabal R.: Conformational flexibility of a novel tetraethylether of thiacalix[4]arene. A comparison with the "classical" methylene-bridged compounds. Tetrahedron Lett. 40, 373-376 (1999) (IF 2.615, cited 41]
Veverka V., Bauerová H., Zábranský A., Lang J., Ruml T., Pichová I., Hrabal R.: Three-dimensional Structure of a Monomeric Form of a Retroviral Protease. J. Mol.Biol. 333, 771-780 (2003) [IF 4.472, cited 5]
Hrabal R., Chen Z., James S., Bennet H.P.J., Ni F.: The hairpin stack fold, a novel protein architecture for a new family of protein growth factors. Nature Structural Biology, 3, 747-652 (1996) [IF 11.085, cited 35]
Zábranská H., Tůma R., Kuhl I., Svatoš A., Ruml T., Hrabal R., Pichová I.: The role of the S-S bridge in retroviral protease fiction And virion maturation. J. Mol. Biol. 365, 1493-1502 (2007) [IF 4.472, cited 2]
Vlach J., Lipov J., Rumlová M., Veverka V., Lang J., Srb P., Knejzlík Z., Pichová I., Hunter E., Hrabal R., Ruml T.: D-retrovirus morhogenetic switch driven by the targeting signal accessibility to Tctex-1 of dynein. Proc. Natl. Acad. Sci. USA 105, 10565-10570 (2008) [IF 9.598, cited 1]
Vlach J., Srb P., Prchal J., Grocký M., Lang J., Ruml T., Hrabal R. (2009) Nonmyristoylated Matrix Protein from the Mason-Pfizer Monkey Virus Forms Oligomers. J. Mol. Biol., 390(5), 967–980. doi:10.1016/j.jmb.2009.05.063
Srb P., Vlach J., Prchal J., Grocký M., Ruml T., Lang J., Hrabal R. (2011) Oligomerization of a retroviral matrix protein is facilitated by backbone flexibility on nanosecond time scale. J. Phys. Chem. B, 115(11), 2634-2644.doi: 10.1021/jp110420m
Prchal, J., Srb, P., Hunter, E., Ruml, T., Hrabal, R. (2012)The Structure of Myristoylated Mason-Pfizer Monkey Virus Matrix Protein and the Role of Phosphatidylinositol-(4,5)-bisphosphate in its Membrane Binding.J.Mol.Biol., 423(3), 427-438. doi:10.1016/j.jmb.2012.07.021
Junkova, P., Vermachova, M., Prchal, J., Kuckova, S., Hrabal, R., Hynek, R. (2013) Improved Approach for the Labeling of Argininne, Glutamic, and Aspartic Acid Side Chains in Proteins Using Chromatographic Techniques. J. Liq. Chromatogr. Relat. Technol., 36(9), 1221-1230. doi:10.1080/10826076.2012.685918
Rozbeský, D., Krejzová, J., Křenek, K., Prchal, J., Hrabal, R., Kožíšek, M., Weignerová, L., Fiore, M., Dumy, P., Křen, V., Renaudet, O. (2014) Re-Evaluation of Binding Properties of Recombinant Lymphocyte Receptors NKR-P1A and CD69 to Chemically Synthesized Glycans and Peptides. Int. J. Mol. Sci., 15(1), 1271-1283. doi:10.3390/ijms15011271
Prchal, J., Kroupa, T., Ruml, T., Hrabal, R. (2014) Interaction of Mason-Pfizer monkey virus matrix protein with plasma membrane. Front. Microbiol. 4(423), doi: 10.3389/fmicb.2013.00423
Kroupa, T., Prchal, J., Doležal, M., Ruml, T., & Hrabal, R. (2014). Cost-effective method for the preparation of uniformly labeled myristoylated proteins for NMR measurements. Protein Expr. Purif., 99, 6-9. doi:10.1016/j.pep.2014.03.005
Junková, P., Prchal, J., Spiwok, V., Pleskot, R., Kadlec, J., Krásný, L., Hynek, R., Hrabal, R. and Ruml, T. (2016), Molecular aspects of the interaction between Mason—Pfizer monkey virus matrix protein and artificial phospholipid membrane. Proteins, 84: 1717–1727. doi:10.1002/prot.25156
Kroupa T., Langerová H., Doležal M., Prchal J., Spiwok V., Hunter E., Rumlová M., Ruml T., Hrabal R. (2016), Membrane Interactions of the Mason-Pfizer Monkey Virus Matrix Protein and Its Budding Deficient Mutants. J.Mol.Biol. 428(23):4708-4722. doi: 10.1016/j.jmb.2016.10.010.
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 27666
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/kontakty/hrabal
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
)
[iduzel] => 27638
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/kontakty
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27690] => stdClass Object
(
[nazev] => Výzkum
[seo_title] => Výzkum
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
V laboratoři probíhá výzkum jednak v oblasti malých organických molekul (kalix[4]areny, jednoduché přírodní látky a jejich analoga a další) a jednak biologických makromolekul – proteinů.

[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[poduzel] => stdClass Object
(
[27697] => stdClass Object
(
[nazev] => Informace
[barva_pozadi] => cervena
[uslideru] => false
[text] =>
[iduzel] => 27697
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] => infobox
[html] =>
[css] =>
[js] =>
[autonomni] => 0
)
)
[69643] => stdClass Object
(
[nazev] => Metabolomika
[seo_title] => Metabolomika
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
NMR-omika, profilování sloučenin v 1H NMR spektrech
NMR spektroskopie se dá s výhodou využít i při analýze komplikovanějších směsí organických látek. Pokud chceme jednotlivé látky ve směsi identifikovat, případně i kvantifikovat, musíme mít k dispozici spektra čistých látek. Identifikace jednotlivých látek pak může proběhnout i na základě jediného signálu, který je ve spektru celé směsi dobře rozpoznatelný. Následně je třeba zjistit, zda lze ve spektru směsi nalézt všechny zbývající signály dané látky. Pokud ano, zbývá přizpůsobit proporčně intenzity všech signálů dané látky signálům ve spektru směsi. Porovnání jejich intenzity s intenzitou signálu standardu dostaneme informaci o koncentraci dané látky ve vzorku. Tomuto postupu říkáme profilování sloučenin a lze ho nejlépe uplatnit při analýze přesně vymezené skupiny látek v dané matrici. Takovými vzorky mohou být např. tělní tekutiny, ve kterých hledáme jednotlivé metabolity, potom mluvíme o metabolomice. Na základě koncentrací nejběžnějších organických látek jako jsou jednoduché organické kyseliny, sacharidy, alkoholy apod. můžeme určovat původ a kvalitu potravin pomocí tzv. foodomiky. Aerosolomika se naopak zabývá stanovováním koncentrací látek v ovzduší a následným určováním původu znečištění. Profilování je univerzální přístup, který může nalézt široké uplatnění, dosud je ale ještě v plenkách, minimálně na území České republiky. Nedílnou součástí zpracování získaných dat jsou pokročilé metody statistické analýzy, které nám umožňují nalézt jemné rozdíly v koncentracích látek mezi skupinami, které jsme si dopředu nadefinovali. Můžeme tak rozlišovat mezi vzorky zdravých či nemocných jedinců, případně pomocí predikčních modelů předpovídat, jak se bude vyvíjet rizikový jedinec. V současné době řešíme projekty zaměřené např. na ranou diagnostiku rakoviny slinivky, Alzheimerovy choroby či hepatocelulárního karcinomu. Převážně pracujeme s krevními vzorky, ale analyzovali jsme i vzorky dechového kondenzátu či mozkomíšního moku. Na základě statistické analýzy dokážeme určit metabolity s významnými změnami koncentrací v daných skupinách a následně identifikovat zasažené metabolické dráhy. Pomocí NMR metabolomiky lze monitorovat i vývoj onemocnění v čase, případně sledovat odpověď jedince na probíhající léčbu. Cílenou analýzou lze sledovat i metabolismus daného farmaka v organismu. Možných směrů výzkumu je zkrátka mnoho…
Horník, Š.; Pokorná, P.; Vodicka, P.; Lhotka, R.; Sýkora, J.; Arora, S.; Poulain, L.; Herrmann, H.; Schwarz, J.; Zdímal, V. Positive matrix factorization of seasonally resolved organic aerosol at three different central European background sites based on nuclear magnetic resonance Aerosolomics data. Science of the Total Environment. 2024, 916, 170303. https://doi.org/10.1016/j.scitotenv.2024.170303
Michálková, L.; Horník, Š.; Sýkora, J.; Setnička, V.; Bunganič, B. Prediction of Pathologic Change Development in the Pancreas Associated with Diabetes Mellitus Assessed by NMR Metabolomics. Journal of Proteome Research. 2023, 22(6), 1936-1946. https://doi.org/10.1021/acs.jproteome.3c00047
Michálková, L.; Horník, Š.; Sýkora, J.; Habartová, L.; Setnička, V.; Bunganič, B. Early Detection of Pancreatic Cancer in Type 2 Diabetes Mellitus Patients Based on H-1 NMR Metabolomics. J. Proteome Res. 2021, 20(3), 1744–1753. https://doi.org/10.1021/acs.jproteome.0c00990
Horník, Š.; Michálková, L.; Sýkora, J.; Ždímal, V.; Vlčková, S.; Dvořáčková, S.; Pelclová, D. Effects of Workers Exposure to Nanoparticles Studied by NMR Metabolomics. Appl. Sci. 2021, 11, 6601. https://doi.org/10.3390/app11146601
Horník, Š.; Sýkora, J.; Pokorná, P.; Vodička, P.; Schwarz, J.; Ždímal, V. Detailed NMR analysis of water-soluble organic compounds in size-resolved particulate matter seasonally collected at a suburban site in Prague. Atmospheric Environment 2021, 267, 118757. https://doi.org/10.1016/j.atmosenv.2021.118757
Horník, Š.; Sýkora, J.; Schwarz, J.; Ždímal, V. Nuclear Magnetic Resonance Aerosolomics: A Tool for Analysis of Polar Compounds in Atmospheric Aerosols. ACS Omega 2020, 5(36), 22750–22758. https://doi.org/10.1021/acsomega.0c01634
[urlnadstranka] =>
[ogobrazek] =>
[pozadi] =>
[iduzel] => 69643
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/vyzkum/metabolomika
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27691] => stdClass Object
(
[nazev] => Výzkum malých organických molekul
[seo_title] => Výzkum malých organických molekul
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
Studium konformačních, dynamických a komplexačních vlastností kalix[4]arenů, thiakalix[4]arenů a kalix[4]resorcinarenů
Kalix[n]areny mají unikátní komplexační schopnosti a díky zajímavé molekulární architektuře se uplatnily při syntéze celé řady ligandů pro komplexaci kationtů, aniontů i neutrálních látek. Vzhledem ke své makrocyklické struktuře představuje kalix[4]aren relativně rigidní molekulu, která za normálních podmínek zaujímá tzv. konickou (cone) konformaci, připomínající pohár nebo kalich. Vhodnou substitucí mohou kalix[4]areny zaujmout další konformace – částečně konickou, 1,2- a 1,3-střídavou. Jednou z nejcennějších vlastností kalix[4]arenu je možnost syntézy různých konformerů s přesně definovanou prostorovou strukturou, což má zvláštní význam při návrhu látek s vhodnými komplexačními vlastnostmi. Kalix[n]areny jsou proto využívány k syntéze složitějších receptorů, senzorů, supramolekulárních struktur, modelů enzymů, kapalných krystalů a pod. Nedávno se podařilo syntetizovat sirnou obdobu kalix[4]arenu, kde jsou methylenové můstky základního skeletu nahrazeny atomy síry.
4 základní konformace kalix[4]arenů ![4 konformace kalix[4]arenů](http://old.vscht.cz/nmr/obrazky/vyzkum/4konf.gif)
Studované projekty:
- Konformační a dynamické vlastnosti a kinetika tetraalkylovaných a částečně alkylovaných thiakalix[4]arenů
- Konformační a dynamické vlastnosti kalix[4]resorcinarenů
- Strukturní studie komplexů kalix[4]arenu s anionty
Použitím různých NMR technik (1H, 13C, COSY, 1H-13C HMQC (HSQC), 1H-13C HMBC) je možné provést kompletní přiřazení protonových a uhlíkových signálů celého kalix[4](resorcin)arenového skeletu. Pomocí NOE (Nukleární Overhauserův efekt) určujeme konformace připravených látek, resp. struktury komplexů. Základními metodami k určení dynamického chování je Analýza tvaru čáry (Line Shape Analysis), výměnná spektroskopie (EXSY) a měření podélné a příčné 13C relaxace.
Studium prostorové struktury derivátů calix[n]arenů pomocí metody měření reziduálních dipolárních interakcí
Metoda měření reziduálních dipolárních interakcí (RDC) využívá anizotropní interakci, jejíž velikost je pro danou dvojici interagujících spinů (např. C-H vazbu) úměrná orientaci této skupiny v magnetickém poli. Tuto metodu využíváme pro potvrzení struktury známé z jiné analytické metody (X-RAY) či k určení prostorové struktury látky, u které není možné vypěstovat vhodný monokrystal pro rentgenovou krystalografii.
Aby bylo možné reziduální dipolární interakční konstanty odečíst, tak je nutné molekuly analyzované látky částečně zorientovat, zavést je do vhodného orientujícího media. V naší laboratoři jsme otestovali několik typů orientujících medií a v praxi se nejlépe osvědčily roztoky polyglutamátových a polyacetylenových lyotropních kapalných krystalů.
Srovnání prostorových struktur derivátu calix[4]arenu získaných z různých instrumentálních metod.
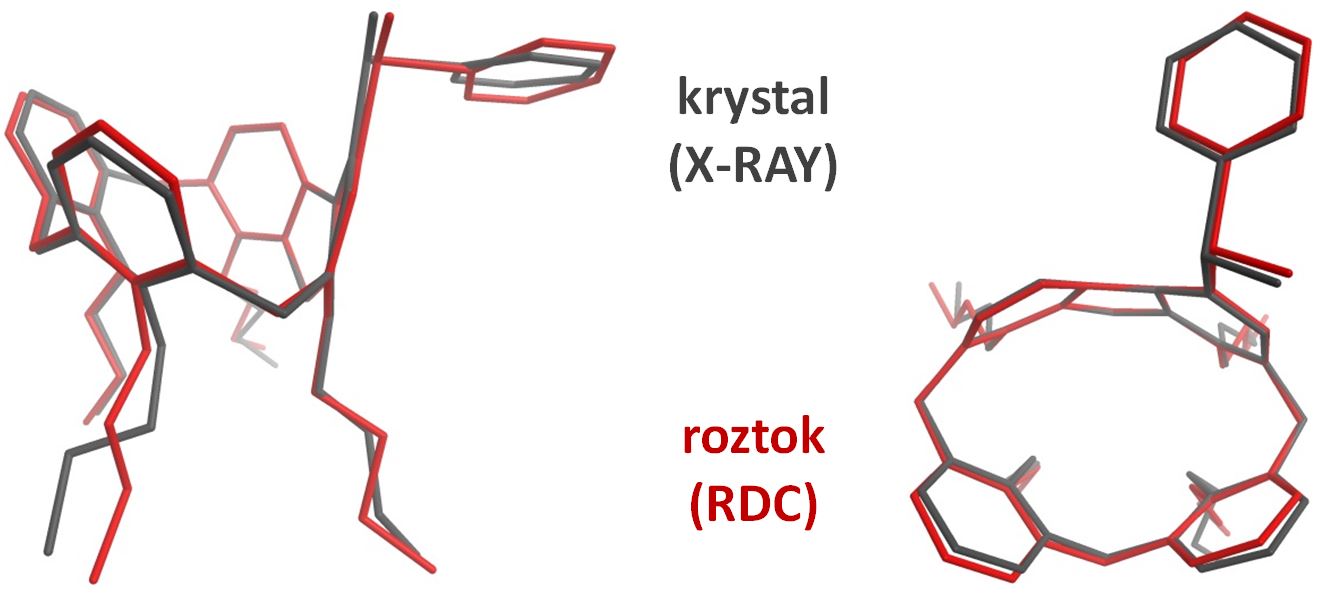
Holub, Jan; Eigner, Václav; Vrzal, Lukáš; Dvořáková, Hana; Lhoták, Pavel, Calix[4]arenes with intramolecularly bridged meta positions prepared via Pd-catalysed double C-H activation., Chemical Communications, Volume49, Issue27, Pages2798-2800.
Konformační analýza derivátů purinů pomocí kombinace NMR spektroskopie a ab-initio výpočetních metod.
Puriny a jejich deriváty jsou často studovanými látkami vzhledem k jejich možnému farmakologickému využití. Pro aplikaci těchto látek je však podmínkou detailně znát jejich prostorovou strukturu, kterou v naší laboratoři studujeme kombinací klasických metod NMR spektroskopie (1H, 13C-APT, 1H-31C HMQC, 1H-13C HMBC a 1H-15N HMBC), doplněných o výsledky ab-initio výpočtů.
Prvním krokem při výpočtu je lokalizace všech potenciálních konformerů studované látky pomocí konformačního skenu. Populované konformery jsou optimalizovány na DFT úrovni a od těchto struktur je následně možné vypočítat NMR parametry (chemické posuny v 1H, 13C i 15N NMR spektrech.) Pro korelace s experimentálními hodnotami je nejvhodnější využít 13C a 15N NMR data vzhledem k dostatečně vysoké disperzi chemických posunů.
Optimalizované struktury N9-(p-nitrofenyl)adeninu a N7-(p-nitrofenyl)adeninu. Pro každý regioisomer byl nalezen pouze jeden populovaný konformer.
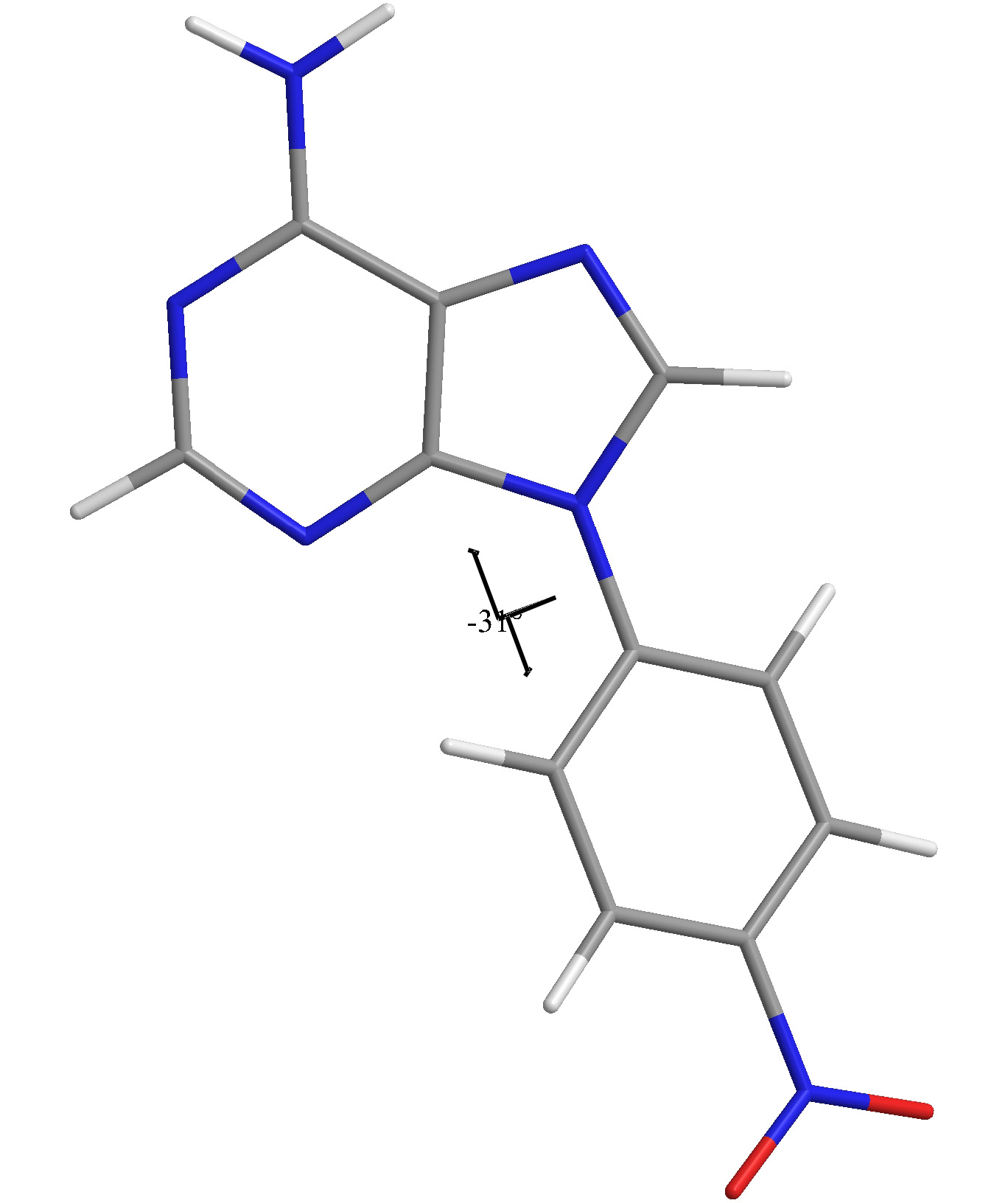
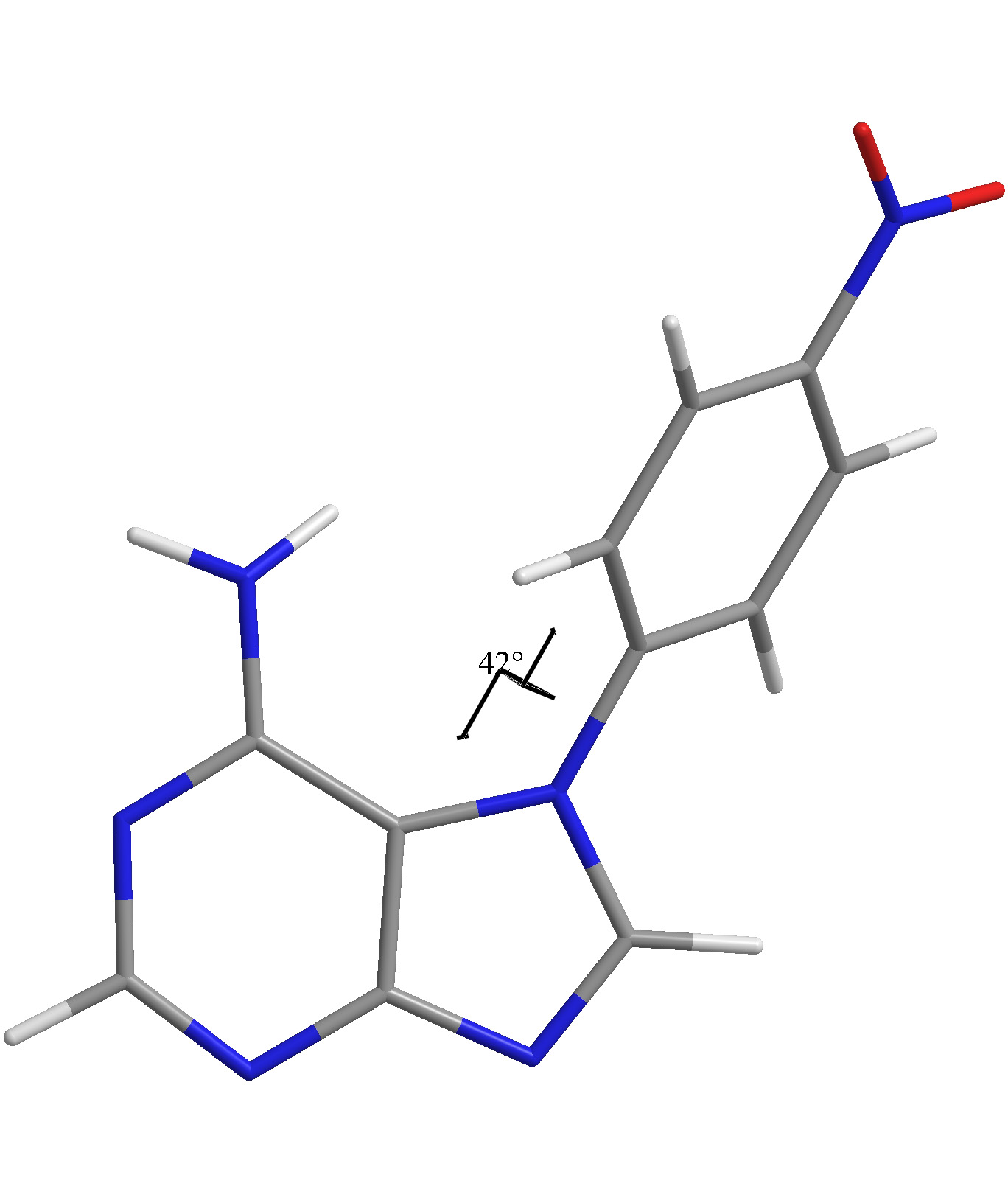
Váňa, Lubomír; Vrzal, Lukáš; Dvořáková, Hana; Himl, Michal; Linhart, Igor; Direct arylation of adenine by fluoro- and chloronitrobenzenes. Effect of microwaves. Synthetic Communications;doi:10.1080/00397911.2013.831902
[iduzel] => 27691
[canonical_url] => //clab.vscht.cz/nmr/vyzkum/organika
[skupina_www] => Array
(
)
[url] => /nmr/vyzkum/organika
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
[27692] => stdClass Object
(
[nazev] => Studium struktury a dynamických vlastností proteinů
[seo_title] => Studium struktury a dynamických vlastností proteinů
[seo_desc] =>
[autor] =>
[autor_email] =>
[obsah] =>
NMR spektroskopie při řešení struktury proteinů
NMR spektroskopie je výborná metoda pro studium struktury proteinů, jakožto i jejich dynamického chování, komplexačních schopností a celé řady dalších důležitých fyzikálně-chemických vlastností. Pro získání prostorové struktury je nutné protein nejprve izotopově obohatit atomy 13C a 15N (všechny atomy uhlíku a dusíku v molekule jsou nahrazeny těmito izotopy). Toho lze dosáhnout expresí příslušného proteinu vhodným expresním systémem (např. v bakteriích Escherichia coli) v izotopově obohaceném růstovém médiu.
Interpretací multidimensionálních multinukleárních NMR experimentů lze přiřadit 1H, 13C a 15N rezonance příslušného proteinu. V další fázi se získávají experimentální NMR parametry (NOE, interakční konstanty, reziduální dipolární interakční konstanty...), které lze přímo využít pro výpočet prostorové struktury proteinu. Dynamické vlastnosti proteinů se získávají měřením relaxačních vlastností jader 13C a 15N. Podrobnější informace o studiu proteinů pomocí NMR je možné získat v rámci námy vyučovaných předmětů.
V naší laboratoři využíváme NMR spektroskopii pro studium prostorové struktury a různých fyzikálně-chemických vlastností* retrovirových proteinů. Retroviry jsou podskupinou virů, jejichž genetická informace je kódována diploidní ribonukleovou kyselinou RNA a pomocí enzymu zvaného reverzní transkriptasa je přepisována do příslušné DNA, která je poté vložena do genomu hostitelské buňky.
Nejznámějším a nejlépe prozkoumaným retrovirem je virus HIV-1, který je příčinou nemoci AIDS (Acquired ImmunoDeficiency Syndrome). V naší laboratoři jsme se zaměřili na Masonův-Pfizerův opičí virus (zkratka M-PMV). Tento virus byl poprvé izolován z prsního tumoru opice druhu Makak. M-PMV není člověku přímo nebezpečný, ale představuje vynikající modelový systém pro studium obecných zákonitostí různých fází života retrovirů.
Studované projekty
- Studium struktury matrixového proteinu Mason-Pfizerova opičího viru a jeho interakce s cytoplasmatickou membránou
- Studium vztahů mezi strukturou a funkcí fenotypově významných mutantů matrixového proteinu Masonova-Pfizerova opičího viru.
Studium struktury matrixového proteinu Mason-Pfizerova opičího viru a jeho interakce s cytoplasmatickou membránou
Na obrázku 1 je schematicky znázorněna zralá retrovirová částice. Matrixový protein (MA), který tvoří vnější proteinový obal a těsně přilehá na vnitřní stranu lipidové membrány, je exprimován jako N-terminální doména polyproteinového prekursoru Gag a je odpovědný za celou řadu životních funkcí retrovirů. Především řídí transport proteinových prekursorů do místa skládání (vytvoření) nezralé virové částice, dále je odpovědný za její transport k plasmatické membráně, s níž se také přímo váže a zprostředkovává tak vazbu virové částice k membráně. MA interaguje s membránou pomocí oblasti bazických aminokyselin a také zbytkem kyseliny myristové, který je kovalentně připojen k jeho N-konci.
Obr. 1. Vnitřní uspořádání zralé retrovirové částice. Pod lipidovou dvojvrstvou obsahující transmembránovou (TM – světle modře) a povrchovou (SU – světle zeleně) jednotku Env proteinu je ukotven matrixový protein (MA – tmavě červeně). Vlastní core retroviru je složeno z kapsidového (CA – fialově) a nukleokapsidového (NC – červeně) proteinu, který chrání diploidní retrovirovou RNA (růžově). V core se dále nachází enzymy integrasa (IN – žlutě), reversní transkriptasa (RT – modře) a také proteasa (tmavě zeleně). V případě Masonova-Pfizerova opičího viru je MA, podobně jako u mnoha dalších retrovirů, na N konci kotranslačně myristoylován.
Struktura myristoylovaného matrixového proteinu M-PMV
V naší laboratoři jsme určili strukturu M-PMV MA a to jak jeho nemyristoylované formy, tak i jeho myristoylované formy. Struktury obou forem jsou si podobné, jsou složeny ze 4 helixů v podobném uspořádání jako u MA jiných retrovirů. Kyselina myristová je zanořena do jádra proteinu. Při srovnání struktury myristoylované a nemyristoylované formy MA je patrné, že myristoylace způsobila mírnou změnu orientace I. a II. helixu (Obr. 2), která je důležitá pro interakci se složkami cytoplasmatické membrány.
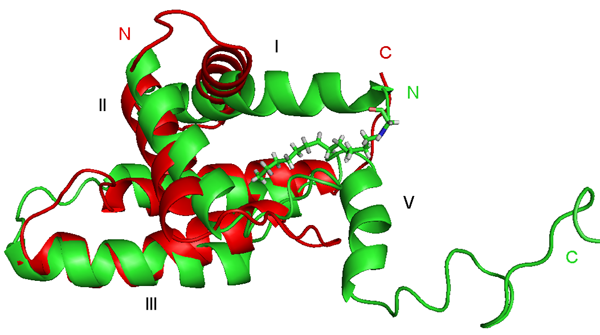
Obr. 2. Srovnání struktury myristoylované (zelená) a nemyristoylované (červená) formy M-PMV MA.
Oligomerizace matrixového proteinu.
Rentgenová struktura matrixového proteinu HIV-1 ukázala, že MA tvoří trimery. HIV-1 MA trimerizuje i v roztoku, ovšem pouze v myristoylované formě. Myr(−) HIV-1 MA nevykazuje v roztoku žádné známky oligomerizace.
Nám se podařilo kombinovaným využitím mapování změn chemických posunů se změnou koncentrace měřeného vzorku (Obr. 3) a změřením translačních difusních koeficientů pomocí gradientní NMR spektroskopie prokázat, že myr(−) M-PMV MA ochotně tvoří dimery a trimery. Tyto výsledky jsou potvrzeny také oligomerizací myr(−) MA, která probíhá jak samovolně v neredukujícím prostředí, tak i za pomoci chemického prokřížení.
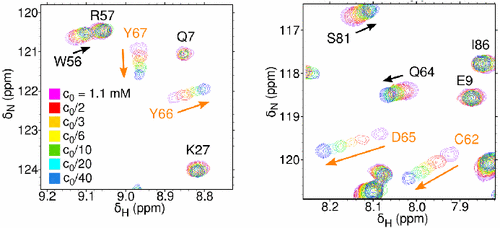
Obr. 3. Překryvy dvou vybraných oblastí 1H-15N HSQC spektra měřených za různých koncentrací WT MA. Oranžovými šipkami jsou označena residua s významnou změnou chemického posunu.
Na základě intenzity změn v chemických posunech v závislosti na koncentraci vzorku jsme nalezli aminokyseliny, které jsou odpovědné za oligomerizaci MA. Nacházejí se ve spojce mezi druhým a třetím helixem a ve třetím helixu a tvoří spojitou oblast na povrchu proteinu – interakční rozhraní (Obr. 4a).
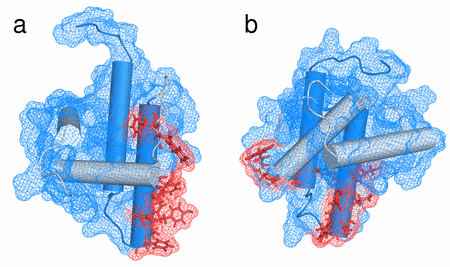
Obr. 4. Interakční rozhraní nalezené na WT MA a zobrazené na WT MA (a) a R55F MA (b). Residua interakčního rozhraní jsou vyznačena červeně.
Molekulárním modelováním se zahrnutím změn v chemických posunech byla navržena možná struktura dimeru a trimeru WT MA, které jsou znázorněny na Obrázku 5.
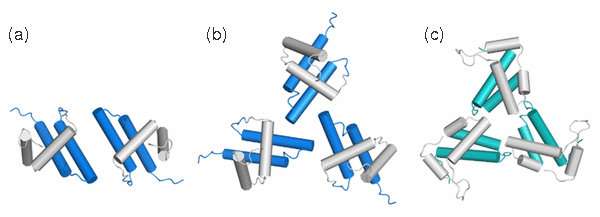
Obr. 5. Modely struktur dimeru (a) a trimeru (b) WT MA vypočítané v programu HADDOCK. Pro srovnání je zde uvedena i struktura trimeru HIV-1 (c, PDB ID 1HIW).
Při studiu myristoylované formy M-PMV MA bylo ovšem překvapivě zjištěno, že myrMA oligomery netvoří. Na rozdíl od (myr-)MA nedochází při změně koncentrace k významným změnám chemických posunů signálů jeho aminokyselin (Obr. 6) a ani jinými metodami se oligomerizaci nepodařilo prokázat. Rozdílné chování obou forem lze vysvětlit změnou konformace oligomerizačního rozhraní způsobenou myristoylací, kdy některé aminokyseliny účastnící se oligomerizace jsou ve struktuře myrMA ukryty. Oligomerizace M-PMV MA tedy nemůže ovlivňovat skládání částice v buňce, protože myristoylovaný MA neoligomerizuje. Je ovšem možné, že po navázání MA na cytoplasmatickou membránu dojde ke konformační změně, která oligomerizaci umožní a ta se bude moci uplatnit například při interakci s proteinem Env.
Interakce s cytoplasmatickou membránou
MA se nachází na povrchu nezralé virové částice a je proto zodpovědný za interakci s buněčnou membránou když virus opouští hostitelskou buňku. Jednou z podstatných složek buněčné membrány je fosfatidylinositol[4,5]-bisfosfát (PI[4,5]P2). V případě matrixového proteinu HIV-1 bylo prokázáno, že se specificky váže na MA a tato interakce je pravděpodobným spouštěcím mechanismem myristoylového přepínače, kdy dojde k expozici zbytku kyseliny myristové, která je takto připravena pro interakci s membránou. Při studiu interakce M-PMV MA s PI[4,5]P2 jsme zjistili, že M-PMV MA také interaguje s PI[4,5]P2, ovšem v mnoha ohledech se od HIV-1 MA odlišuje.
PI[4,5]P2 se váže do vazebného místa mezi I., II. a IV. helixem (Obr. 6). S PI[4,5]P2 interaguje pouze myrMA, protože u (myr-)MA je vazebné místo uzavřeno rozdílnou orientací I. a II. helixu. PI[4,5]P2 má v kavitě zanořené zbytky mastných kyselin zatímco inositolová skupina zůstává na povrchu. Stejně jako je tomu u HIV-1 jedna z mastných kyselin je zanořena přímo do středu proteinu, kdežto druhá je zanořená částečně a její konec směřuje k povrchu proteinu. Tato orientace naznačuje, že v případě přirozeného PI[4,5]P2 jedna z mastných kyselin zůstala jako kotva v cytoplasmatické membráně, stejně jako bylo navrženo u HIV-1 MA. Fosfátové skupiny jsou blízko povrchu a interagují s bazickými aminokyselinami MA (Obr. 7). Celkově je struktura komplexu M-PMV MA s PI[4,5]P2 podobná struktuře komplexu HIV-1 i HIV-2 MA s PI[4,5]P2.
Zkoumali jsme i závislost interakce na různé fosforylaci PIP. Testovali jsme interakci MA s PIP fosforylovanými v pozicích 3; 3,4; 4; 4,5 a 3,4,5. Ve všech případech byla interakce srovnatelná s PI[4,5]P2 a nepodařilo se najít rozdíly v preferenci jednotlivých forem PIP, na rozdíl od HIV-1 a HIV-2 MA, kde byl PI[4,5]P2 jednoznačně preferovaný.
Celkově je interakce PI[4,5]P2 s M-PMV MA slabší než s HIV-1 MA. U M-PMV MA, na rozdíl od HIV-1 MA, také při interakci s rozpustným PI[4,5]P2 s krátkými zbytky mastných kyselin nedochází k uvolnění myristoylu z jádra proteinu.
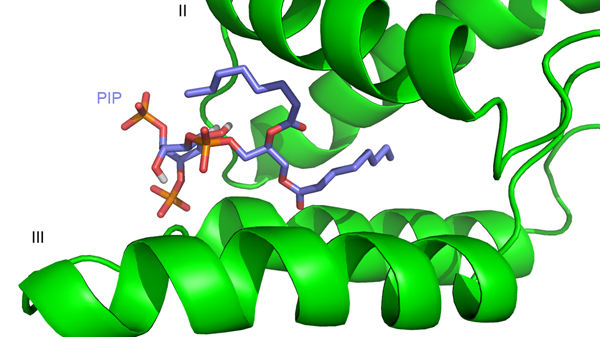
Obr. 6 Komplex myristoylovaného MA (zelený) s PI[4,5]P2 vypočtený v programu HADDOCK.
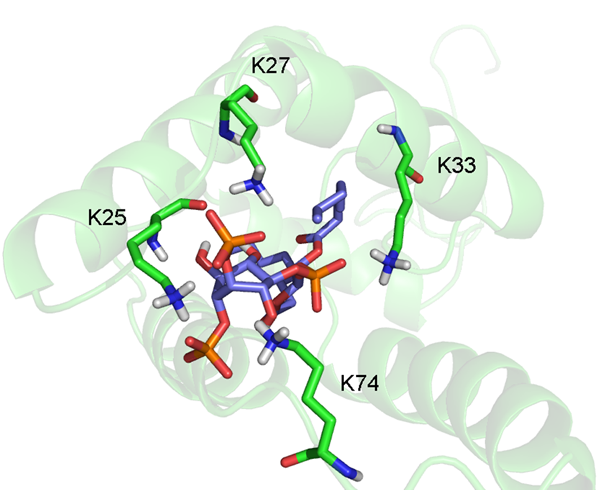
Obr. 7 Komplex myristoylovaného MA (zelený) s PI[4,5]P2se zvýrazněnou interakcí lyzinových zbytků MA (zelené) s fosfátovými skupinami PI[4,5]P2 (červené).
Vybrané publikace:
- Vlach J., Srb P., Prchal J., Grocký M., Lang J., Ruml T., Hrabal R. (2009) Nonmyristoylated Matrix Protein from the Mason-Pfizer Monkey Virus Forms Oligomers. J. Mol. Biol., 390(5), 967–980. doi:10.1016/j.jmb.2009.05.063
- Srb P., Vlach J., Prchal J., Grocký M., Ruml T., Lang J., Hrabal R. (2011) Oligomerization of a retroviral matrix protein is facilitated by backbone flexibility on nanosecond time scale. J. Phys. Chem. B, 115(11), 2634-2644.doi: 10.1021/jp110420m
- Prchal J., Junková P., Strmisková M., Lipov J., Hynek R., Ruml T., Hrabal R. (2011) Expression and purification of myristoylated matrix protein of Mason-Pfizer monkey virus for NMR and MS measurements. Protein Expr. Purif., 79(1), 122-127. doi: 10.1016/j.pep.2011.05.010
- Prchal, J., Srb, P., Hunter, E., Ruml, T., Hrabal, R. (2012)The Structure of Myristoylated Mason-Pfizer Monkey Virus Matrix Protein and the Role of Phosphatidylinositol-(4,5)-bisphosphate in its Membrane Binding.J.Mol.Biol., in press, doi:10.1016/j.jmb.2012.07.021
Studium vztahů mezi strukturou a funkcí fenotypově významných mutantů matrixového proteinu Masonova-Pfizerova opičího viru.
Změna místa skládání nezralé virové částice.
Z hlediska místa skládání nezralé virové částice se retroviry dělí na C- a D-typ (Obr. 8). Retroviry C-typu (HIV-1) skládají nezralé virové částice na vnitřní straně buněčné membrány, zatímco viry typu D (M-PMV) v tzv. pericentriolární oblasti infikované buňky. Rozdíl mezi oběma fenotypy je velmi nepatrný, jak bylo prokázáno mutacemi matrixového proteinu M-PMV a později i u HIV-1. V případě M-PMV byl zaměněn arginin v pozici 55 za hydrofobní aromatickou aminokyselinu (Trp, Phe), čímž dochází ke změně místa skládání kapsidy z pericentriolární oblasti na vnitřní stranu plasmatické membrány (konverze D-typu na C-typ). Různými experimenty bylo prokázáno, že fenotyp typu D je závislý na buněčném transportním systému dyneinu.
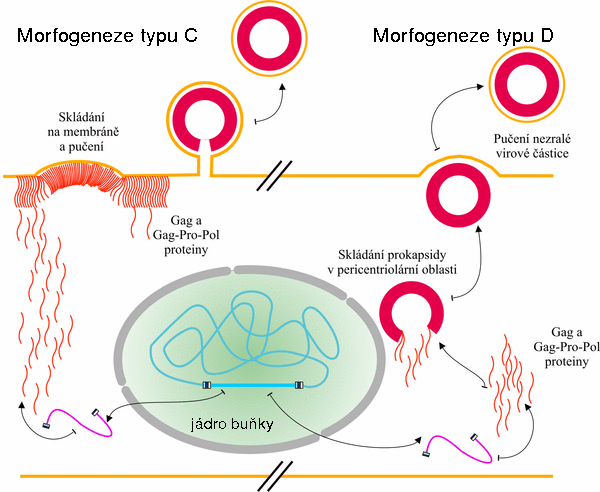
Obr. 8. Dvě různé morfogeneze retrovirů, typ C a typ D. U retrovirů typu C (např. u HIV-1) dochází ke skládání virové částice na cytoplasmatické membráně hostitele (vlevo), kdežto u retrovirů typu D (M-PMV) se Gag prekursory skládají v prokapsidu v pericentriolární oblasti buňky, odkud je tato prokapsida transportována k membráně, kde vypučí (na obrázku vpravo).
V naší laboratoři se podařilo určit strukturu jak divokého typu matrixového proteinu (wt MA), tak mutantu R55F (Obr. 9). Zásadním rozdílem mezi oběma proteiny je přístupnost tzv. CTRS domény (Cytoplasmic Targeting and Retention Signal), která je odpovědná za cílení virových proteinů do pericentriolární oblasti prostřednictvím interakce s lehkým řetězcem dyneinu (Tctex-1). CTRS v nemutovaném MA je plně exponovaná na povrchu proteinu, a tedy přístupná k interakci s buněčným transportním systémem. Ve struktuře mutantu R55F dochází k omezení její přístupnosti v důsledku vzájemné reorientace N- (helix I a II) a C-koncové domény (helix III a IV) proteinu. Prokázali jsme tedy, že v důsledku omezené přístupnosti CTRS domény nemůže Gag polyprotein interagovat s dyneinem, čímž je zablokován mechanismus transportu Gag polyproteinů do oblasti poblíž jádra buňky. Místo toho je v mutantu R55F aktivován tzv. bipartitní transportní signál, kterým jsou Gag proteiny dopravovány k vnitřní straně plasmatické membrány. Tím dochází ke změně fenotypu viru z D na C.
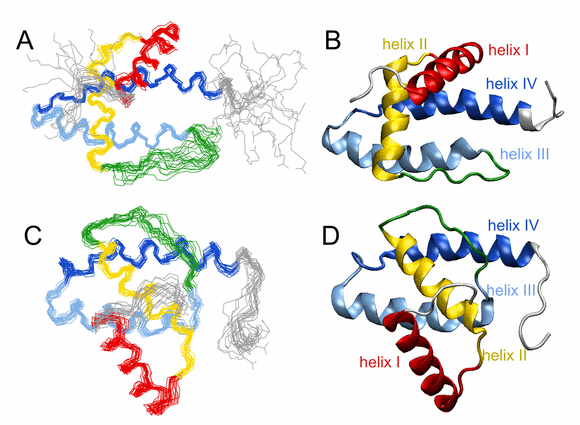
Obr. 9. Srovnání struktur wt MA a R55F, (A) Superpozice 18 nejlepších struktur wt MA, (B) průměrná struktura wt MA, (C) superpozice 15 nejlepších struktur R55F, (D) průměrná struktura R55F. Jednotlivé α-helixy jsou popsány a všechny důležité strukturní prvky jsou barevně odlišeny.
Na rozdíl od WT MA mutant R55F nevykazoval téměř žádné známky oligomerizace. Rozdílné chování obou proteinů lze vysvětlit na základě jejich odlišné struktury, resp. odlišné přístupnosti CTRS domény, která je majoritní složkou oligomerizační domény (Obr. 4b).
Vybrané publikace:
- Vlach, J., Lipov, J., Veverka, V., Rumlová, M., Ruml, T., Hrabal, R. 2005. Assignment of H-1, C-13, and N-15 resonance of wt matrix protein and its R55F mutant from Mason-Pfizer monkey virus. J. Biomol. NMR. 31: 381-382. doi: 10.1007/s10858-005-2473-x
- Vlach J., Lipov J., Rumlová M., Veverka V., Lang J., Srb P., Knejzlík Z., Pichová I., Hunter E., Hrabal R., Ruml T. 2008. D-retrovirus morhogenetic switch driven by the targeting signal accessibility to Tctex-1 of dynein. Proc. Natl. Acad. USA 105: 10565-10570. doi: 10.1073/pnas.0801765105
[iduzel] => 27692
[canonical_url] => //clab.vscht.cz/nmr/vyzkum/proteiny
[skupina_www] => Array
(
)
[url] => /nmr/vyzkum/proteiny
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
)
[iduzel] => 27690
[canonical_url] =>
[skupina_www] => Array
(
)
[url] => /nmr/vyzkum
[sablona] => stdClass Object
(
[class] => stranka
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
)
)
[sablona] => stdClass Object
(
[class] => stranka_submenu
[html] =>
[css] =>
[js] =>
[autonomni] => 1
)
[api_suffix] =>
)
 [logo_mobile_href] => /
[logo_mobile] =>
[logo_mobile_href] => /
[logo_mobile] => 














![4 konformace kalix[4]arenů](http://old.vscht.cz/nmr/obrazky/vyzkum/4konf.gif)










